Sie haben sich erfolgreich abgemeldet.
Not registered yet?
Medizinprodukte-Verordnung
Informationen zur Medizinprodukteverordnung
Die neue europäische Medizinprodukteverordnung (MDR) mit vielen neuen Regeln ist eine Herausforderung für alle Beteiligten. B. Braun bereitet sich intensiv vor und möchte die neuen Anforderungen so schnell wie möglich anwenden. Hier haben wir einige Informationen zum MDR für Sie zusammengestellt.
Die neue europäische Medizinprodukteverordnung (MDR) ist im Mai 2017 in Kraft getreten. Die neue Verordnung ersetzt die bestehende Medizinprodukterichtlinie (MDD) und die Richtlinie über aktive implantierbare Medizinprodukte (AIMDD ).
In Zukunft werden die derzeit ca. 500.000 Medizinprodukte in Europa nach der neuen, wesentlich umfassenderen Richtlinie für den Erhalt der CE-Kennzeichnung rezertifiziert. Nach aktuellen Schätzungen werden nur etwa 65 Prozent der Medizinprodukte nach der neuen Verordnung zertifiziert. Einige benannte Stellen befinden sich noch in der Akkreditierungsphase, und es ist nicht ganz klar, wie viele benannte Stellen den Prozess abschließen können (Liste auf der Website der Europäischen Kommission). Aufgrund der gestiegenen Anforderungen an die benannten Stellen und die Hersteller sind Portfolioanpassungen zu erwarten und unumgänglich.
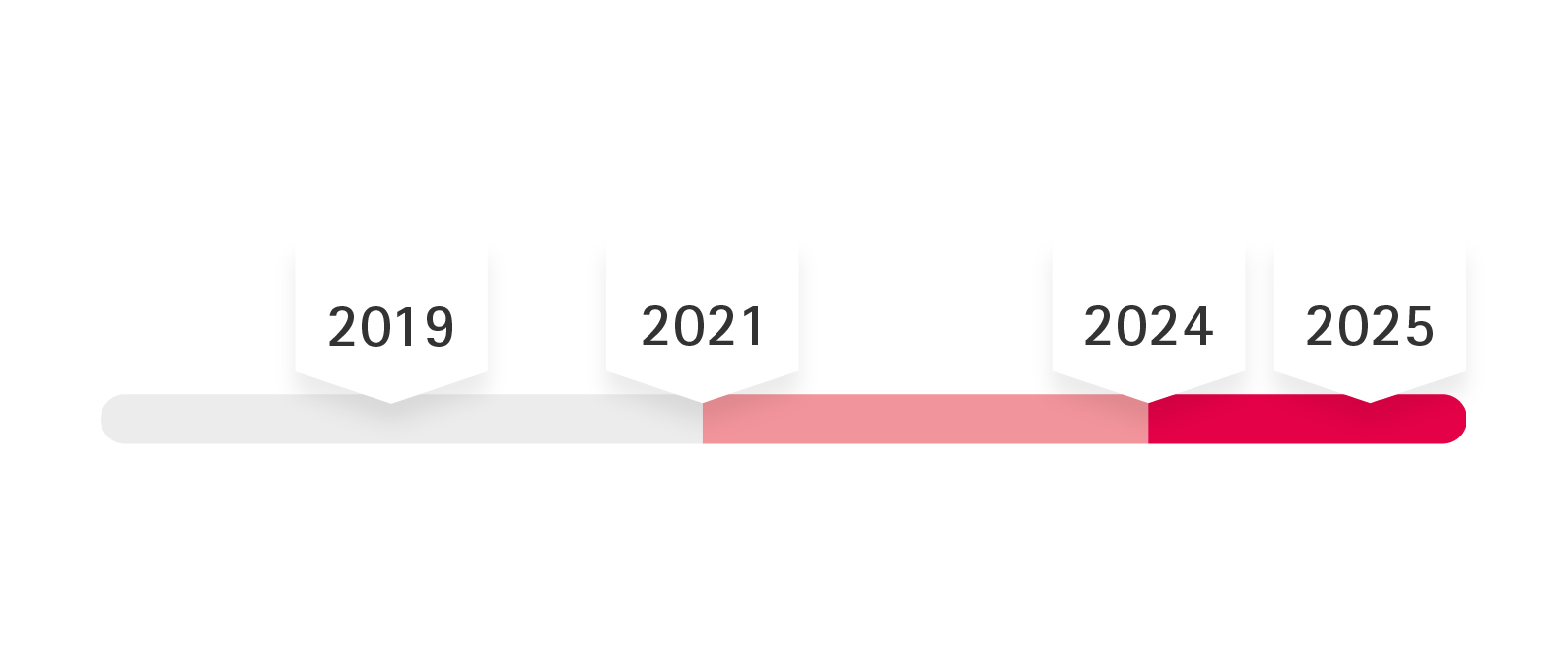
Umsetzungszeitplan der MDR bei B. Braun
Die MDR ist am 25. Mai 2017 in Kraft getreten. Hier finden Sie eine Übersicht über die Implementierungsdaten und -zeiträume.
Betroffen sind unter anderem diese Bereiche:
- Klassifizierungsregeln: Die Regeln wurden um die Klasse Ir (wiederverwendbare chirurgisch invasive Instrumente) erweitert. Die Anforderungen an implantierbare Produkte der Klasse llb sind gestiegen. Für mehrere Produktkategorien wurden neue Risikoklassen eingeführt, was möglicherweise eine höhere Klassifizierung von Produkten zur Folge hat.
- Klinischer Nachweis: Zukünftig unterliegen alle Medizinprodukte einer klinischen Bewertungspflicht, unabhängig von der Klasse.
- Prüfverfahren (Konsultationsverfahren ): Neue implantierbare Produkte der Klasse III und aktive Produkte der Klasse llb, die Arzneimittel verabreichen und/oder entfernen, sollen vor dem Markteintritt strenger kontrolliert werden.
- Benannte Stellen: Die Anforderungen an die benannten Stellen steigen. Gleichzeitig sind sie künftig verpflichtet, unangekündigte Audits bei Herstellern durchzuführen.
- Technische Dokumentation: Die Dokumentation durch die MDR erhöht den Aufwand für die Hersteller deutlich.
- EUDAMED: Eine elektronische Datenbank zur Überwachung des Produktlebenszyklus wurde eingeführt.
Um eine kontinuierliche Versorgung mit sicherer und innovativer Medizintechnik gewährleisten zu können, stehen alle Hersteller vor der herausfordernden Aufgabe, die gestiegenen Anforderungen zu überwinden, die für den Erhalt der CE-Kennzeichnung notwendig sind. Die benannten Stellen müssen die Grundlagen für das Konformitätsbewertungsverfahren schaffen und ausreichende Kapazitäten schaffen. Derzeit ist unklar, ob dies realistisch innerhalb des bekannten Zeitrahmens für die Umsetzung der MDR erreicht werden kann.
Bereits zu einem früheren Zeitpunkt hat B. Braun mit weitreichenden Vorbereitungen für die Zertifizierung eigener Medizinprodukte nach MDR begonnen. Dies gilt selbstverständlich für alle Produkte, die B. Braun selbst herstellt oder als Handelsware zur Vervollständigung seines Portfolios erwirbt. Im Hinblick auf den Fortschritt der getroffenen Maßnahmen ist B. Braun zuversichtlich, dass es die Anforderungen der MDR bis Mai 2024 erfüllen kann, wenn alle Produkte MDR-konform sein müssen.
Allgemeine FAQs zum MDR
Die MDR definiert die Anforderungen, die ein Hersteller erfüllen muss, um Medizinprodukte in Europa zu vertreiben. Betroffen sind sowohl die technischen Anforderungen an ein Produkt als auch die Anforderungen an die Überwachung von Produkten, die in Gesundheitseinrichtungen eingesetzt werden.
Es gibt mehrere Änderungen in Bezug auf die Klassifizierung von Produkten. Neben der Einführung der neuen Klasse lr für wiederverwendbare chirurgische Instrumente wurden insbesondere die Anforderungen an implantierbare Produkte der Klasse IIb erhöht. Darüber hinaus wurden zahlreiche Produktkategorien einer höheren Risikoklasse zugeordnet. Die MDR erhöht die Anforderungen an den klinischen Nachweis von Medizinprodukten. In Zukunft benötigen alle Medizinprodukte, unabhängig von ihrer Risikoklasse, eine klinische Bewertung. Das neu eingeführte Prüfverfahren bedeutet die verbesserte Überwachung neuer, implantierbarer Produkte der Risikoklasse III sowie aktiver Medizinprodukte, die Arzneimittel der Klasse IIb vor der Markteinführung verabreichen und/oder entfernen. Zusätzlich zu den gestiegenen Anforderungen an die Hersteller gibt es nun strengere Vorschriften für die benannten Stellen. Um Medizinprodukte zulassen zu können, müssen verschiedene zusätzliche Anforderungen erfüllt sein. Auch sind die benannten Stellen verpflichtet, unangekündigte Audits bei Herstellern durchzuführen. Zusätzliche Anforderungen an die technische Dokumentation, die von den Herstellern zur Verfügung gestellt werden müssen, erhöhen den Umfang und die Komplexität der Dokumentation erheblich.
Es gibt keine genaue Kennung auf dem Produkt, die auf die MDR-Konformität hinweist. Dennoch wird mit der Einführung der MDR ein neues ISO-Symbol "MD" für Medizinprodukte auf dem Etikett angebracht.
Ja, betroffen sind alle Medizinprodukte aller Risikoklassen, einschließlich der Behandlungseinheiten und -systeme.
Daten, die für die Öffentlichkeit relevant sind, werden in einer zentralen europäischen Datenbank zugänglich gemacht, die bereits heute existiert. Die erweiterte Version von EUDAMED wird schrittweise eingeführt, d.h. die freiwillige Verwendung einer "Minimal Viable Product" (MVP) -Version im Jahr 2022. Die obligatorische Verwendung der EUDAMED wird voraussichtlich im zweiten Quartal 2025 erfolgen. Siehe EUDAMED-Zeitleiste
Legale Hersteller, System- und Behandlungspackungshersteller, Importeure oder Bevollmächtigte für den Vertrieb von Medizinprodukten in der EU müssen zu EUDAMED Daten über die Rolle des Akteurs sowie die produktrelevanten Daten für jedes einzelne Produkt, das in der EU vertrieben werden soll, ergänzen.
Nach der Veröffentlichung der MDR am 5. Mai 2017 trat die Verordnung am 25. Mai 2017 in Kraft, mit einer Übergangsfrist, die bis zum 26. Mai 2020 dauern sollte. Aufgrund der COVID-19-Pandemie wurde die verpflichtende Anwendung der MDR auf Mai 2021 verschoben. Bis max. Am 26. Mai 2024 behalten MDD-Zertifikate ihre Gültigkeit (z.B. für Produkte der Risikoklassen II und III), es sei denn, es ist erforderlich, dass ein MDD-Zertifikat durch ein MDR-Zertifikat ersetzt werden muss (z.B. für Produkte der Risikoklasse 1). Nach dem 26. Mai 2025 dürfen Produkte mit MDD-Zertifikat nicht mehr in Verkehr gebracht werden.
Aufgrund der COVID-19-Pandemie wurde die Pflichtanwendung für MDR auf den 26. Mai 2021 festgelegt. Daraus ergeben sich folgende Fristen für die Vermarktung von Medizinprodukten nach Produktklassen:
Klasse I: 26. Mai 2021
Klasse Ir, s, m, Klasse IIa, Klasse IIb und Klasse III: 26. Mai 2024
Nein, alle Produkte, die vor dem 25. Mai 2021 in Verkehr gebracht wurden, können für weitere vier Jahre vertrieben werden. Produkte, die vor Mai 2025 in Betrieb genommen werden, können auch vom Endverbraucher genutzt werden.
Aus der Konformitätsbewertung geht hervor, ob ein Produkt und der jeweilige Hersteller die europäischen MDR-Anforderungen erfüllen. Je nach Risikoeinstufung der einzelnen Produkte ist B. Braun berechtigt, dieses Audit selbst durchzuführen. Die zusätzlichen Bewertungen werden über eine sogenannte "benannte Stelle" durchgeführt.
Eine benannte Stelle ist ein privates Unternehmen, das im Namen der Europäischen Union benannt wird, um die Konformität eines Herstellers mit der MDR zu bewerten. Derzeit werden sie mit Audits bewertet und nach bestandenen Audits bewerten die Benannten Stellen die Prozesse der Medizinproduktehersteller auf MDR-Konformität. Sobald die Einhaltung der Prozesse überprüft wurde, können Produkte, die verarbeitet werden, durch diese Prozesse registriert werden.
Auch nach der Umstellung des gesamten Produktportfolios auf MDR entstehen den Herstellern durch die gestiegenen Anforderungen der MDR erhebliche Mehrkosten.
Die Hauptziele der Verordnung sind ein besserer Schutz der öffentlichen Gesundheit und der Patientensicherheit, mehr Transparenz, Rechtssicherheit und ein stärker europäisch orientiertes Konzept. Dies soll durch eine umfangreichere technische Dokumentation der betroffenen Produkte in einem MDR-konformen Qualitätsmanagementsystem erreicht werden.
FAQs zum MDR & B. Braun
Als Hersteller von Medizinprodukten muss B. Braun die Anforderungen bis Mai 2021 erfüllen. Verschiedene Arbeitsgruppen aktualisieren die Technische Dokumentation und überarbeiten die Prozesse, um sie MDR-konform zu machen. Darüber hinaus ist B. Braun verpflichtet, EUDAMED Produktinformationen, einschließlich eindeutiger Geräteidentifikationsdaten (UDI), sowie Informationen zur Überwachung nach dem Inverkehrbringen zur Verfügung zu stellen.
Der B. Braun Konzern hat bereits umfassende Maßnahmen eingeleitet und Ressourcen bereitgestellt, um die termingerechte Umsetzung der MDR sicherzustellen.
Alle Medizinprodukte und ln-vitro Diagnostika. Auch alle Produkte, die erstmals nach der neuen Klasse Ir zertifiziert sind.
B. Braun bereitet sich seit einiger Zeit intensiv auf die neuen Regelungen vor und geht davon aus, den Zeitplan einhalten zu können.
Die Qualitätsmanagementsysteme der B. Braun Melsungen AG, der B. Braun Avitum AG und der Aesculap AG sind bereits nach der MDR zertifiziert und MDR-konforme technische Dokumentationen für unsere Produkte wurden bereits erstellt . Die Produktübergabe an den MDR erfolgt sukzessive bis zur maximalen Laufzeit Anfang 2024.
Generell ja, je nach geplantem Lebenszyklus sind die Produkte nach MDR zertifiziert. Wie in den Vorjahren wird B. Braun sein Produktportfolio weiter ausbauen. Neue Produkte werden in das Portfolio aufgenommen und ältere Generationen werden ersetzt oder unwirtschaftliche oder veraltete Produkte werden aus dem Produktportfolio entfernt. Im Rahmen unseres regelmäßigen Sortimentsmanagementprozesses werden wir entsprechende Produktsortimentsänderungen weiterhin zeitnah, offen, transparent und zielgerichtet an die jeweiligen betroffenen Kunden kommunizieren und nach Möglichkeit Alternativen anbieten.
B. Braun nutzt die MDR-Übergangsfrist, in der wir unser Produktportfolio bis spätestens Mai 2024 auf die MDR umstellen werden. In dieser Übergangszeit wird B. Braun sowohl MDD- als auch MDR-zertifizierte Produkte auf den Markt bringen.
TÜV Süd wurde im Mai 2019 als zweite benannte Stelle weltweit anerkannt. Weitere benannte Stellen, die Medizinprodukte von B. Braun betreuen, sind MedCert, Dekra und TÜV Rheinland, die ebenfalls im MDR benannt wurden. Bitte überprüfen Sie den Link zur Website der Europäischen Kommission, um einen Überblick über MDR-akkreditierte benannte Stellen zu erhalten.
Website der Europäischen Kommission
a) Die Identifizierung eines Medizinprodukts ändert sich durch die Einbeziehung der eindeutigen Geräteidentifikation (UDI).
b) Es ist möglich, dass durch neue Produkte der Klasse III erweiterte Dokumentationspflichten entstehen.
c) Die EUDAMED-Datenbank bietet Kunden mehr Transparenz in Bezug auf Produkte.
B. Braun ist MDR-ready und hat dafür bereits hohe Investitionen im mehrstelligen Millionenbereich getätigt. Hauptkostenfaktoren sind umfassendere Anforderungen an die technische Dokumentation, technische und systemische Lösungen zur Erfüllung des erforderlichen EUDAMED-Datenmanagements sowie verstärkte Überwachungsanstrengungen nach dem Inverkehrbringen.
B. Braun unterstützt Kunden aktiv bei der Informationsbeschaffung. Zu diesem Zweck werden seit Mai 2021 sukzessive Entsprechenserklärungen und Informationen zur Nutzung (IFU) digital zur Verfügung gestellt.
Konformitätserklärungen finden Sie online unter www.bbraun.com - indem Sie einfach den Produktnamen in das Suchfeld eingeben und die entsprechende Konformitätserklärung unter der Rubrik -Zugehörige Dokumente- finden. Die meisten Entsprechenserklärungen der B. Braun Melsungen AG und der B. Braun Avitum AG können über diesen Kanal abgerufen werden. Aus technischen Gründen wird B. Braun die Konformitätserklärungen für Produkte der Aesculap AG (mit Ausnahme des Nahtmaterialportfolios) mittelfristig nur online zur Verfügung stellen können. Für die stichprobenartige Bereitstellung von Konformitätserklärungen, die online nicht zu finden sind, können die bekannten Ansprechpartner aus dem Kundenservice der B. Braun Landesgesellschaft angesprochen werden.
Eine Gebrauchsanweisung kann unter https://eifu.bbraun.com heruntergeladen werden. Nach Eingabe der Artikelnummer oder der GTIN werden die zum Produkt gehörenden Dokumente angezeigt.
Hier finden Sie eine Sammlung nützlicher Links zu Informationen auf offiziellen Websites der Europäischen Kommission und anderen Quellen.
Bleiben Sie in Verbindung mit My B. Braun
Mit Ihrem personalisierten Konto wird Ihr Online-Erlebnis einfacher, bequemer und sicherer.