Mikrobielle Kontamination
Mikrobielle Kontamination ist eine nicht beabsichtigte oder versehentliche Einbringung potentiell infektiöser Organismen bzw. toxischen Materials wie Bakterien, Pilze wie Hefen und Schimmelpilze, Viren, Protozoen oder deren Toxine und andere pathogene Erreger.1,2
“Eine nosokomiale Infektion oder ‚Krankenhausinfektion‘ ist wie folgt definiert:
Eine Infektion eines Patienten in einem Krankenhaus oder einer Pflegeeinrichtung, die zum Zeitpunkt der Aufnahme nicht vorhanden war. Dazu gehören Infektionen, die Patienten im Krankenhaus erwerben (die nach ca. 48 Std. manifest werden), jedoch erst nach der Entlassung in Erscheinung treten sowie berufsbedingte Infektionen bei Mitarbeitern der Einrichtung.”3
Mikrobielle Krankheitserregertypen
Es gibt zahlreiche mikrobielle Krankheitserreger, die zu einer Kontamination führen und u. U. Infektionen verursachen können. Innerhalb dieser Gruppe werden verschiedene Arten von Krankheitserregern unterschieden:
Bakterien
Mikroorganismen mit einer Größe von bis zu 5 μm, die im Zusammenhang mit mikrobieller Kontamination die wichtigste Gruppe der pathogenen Keime darstellen. Bakterien werden entsprechend der Struktur ihrer Zellwände in grampositive und gramnegative Bakterien unterteilt.
Bakterien können weiter unterschieden werden:
Symbiotische Bakterien
Symbiotische Bakterien sind Bestandteil der normalen, sogenannten „residenten“ Hautflora des Menschen. Diese Bakterien sind normalerweise harmlos für den gesunden Menschen bzw. üben vielmehr eine bedeutende Schutzfunktion aus, indem sie die Besiedelung mit pathogenen Mikroorganismen verhindern. Manche symbiotischen Bakterien können jedoch Infektionen verursachen, wenn der natürliche Wirtsorganismus geschwächt ist oder wenn die Bakterien in das Gewebe des Wirts eingebracht werden.
Pathogene Bakterien
Pathogene Bakterien besitzen gegenüber nicht-pathogenen Spezies eine Virulenz, d.h. eine „Infektions-Fähigkeit“ und können unabhängig vom Krankheitszustand des Wirts Infektionen und dadurch bedingte Krankheiten verursachen.3
Viren
Viren sind subzelluläre biologische Objekte mit einer Größe von 20–200 nm. Sie existieren mit („behüllt“) und ohne („unbehüllt“) Virushülle (meist eine aus der Wirtsmembran geformte Ummantelung, die den Virus umhüllt) und können schwere Infektionen verursachen.
Prionen
Prionen sind infektiöse Proteinpartikel. Sie sind mit einer Größe von < 5 nm die kleinsten Pathogene.
Sowohl Prionen als auch Viren sind Partikel ohne eigenen Metabolismus und werden deshalb nicht als lebende Organismen betrachtet. Zur Fortpflanzung sind sie vom Metabolismus eines Wirt-Organismus abhängig.3
Pilze, Hefepilze und Protozoen
Pilze, Hefepilze und Protozoen mit einem Durchmesser von 200 µm sind drei weitere Gruppen von Infektionsquellen.
Definition katheterassoziierter Blutbahninfektionen (CRBSI: Catheter-related bloodstream infections)
Die Definition von CRBSI hilft bei der Beurteilung, ob ein Katheter die Hauptquelle einer Bakteriämie im Patienten ist. Hierzu zählen Infektionen an der Austrittsstelle und entlang des Tunnels, die folgendermaßen definiert sind:
- Erythem oder Verhärtung in einem Bereich von 2 cm um die Katheteraustrittsstelle mit oder ohne begleitende Blutbahninfektion oder Purulenz.
- Bei Tunnelinfektionen Druckschmerzhaftigkeit, Erythem oder Verhärtung in einem Bereich > 2 cm von der Kathetereintrittsstelle ausgehend entlang des subkutan liegenden Katheters ohne begleitende Blutbahninfektion.4
Eine mikrobielle Kontamination ist besonders gefährlich für Patienten, wenn eine parenterale Therapie über einen intravenösen Katheter verabreicht wird. In diesem Fall können die Krankheitserreger direkt in den Systemkreislauf gelangen und eine katheterassoziierte Blutbahninfektion (CRBSI) verursachen oder verschiedene Organe befallen und Organversagen auslösen.
Aus diesem Grund ist die Prävention von CRBSI von entscheidender Bedeutung. Die Anfang der 2000er Jahre veröffentlichte Standarddefinition der Centers of Disease Control and Prevention (CDC) für CRBSI ist eine weithin akzeptierte Definition.5
Bakterielle Infektionen können in den meisten Fällen mit Antibiotika behandelt werden. In manchen Fällen ist eine Behandlung jedoch äußerst schwierig oder gar unmöglich, da die Bakterien immer häufiger Mehrfachresistenzen gegenüber Antibiotika aufweisen. Auch gegen die Mehrzahl der Viruserkrankungen und Prionen sind keine wirksamen Arzneimittel verfügbar. Deshalb ist die Prävention solcher Infektionen von ausschlaggebender Bedeutung.
Inzidenz und Prävalenz von MRE (Multi-Resistente Erreger)
Definition multi-resistenter Bakterien
Multiresistenz ist ein Zustand, bei dem ein krankheitserregender Organismus in der Lage ist, bestimmten zur Vernichtung des Organismus eingesetzten Arzneimitteln (Antibiotika) oder chemischen Stoffen mit unterschiedlichster Struktur und Funktion zu widerstehen.
Zu den bedeutendsten multiresistenten Organismen zählen (nach ECDC – Cassini6 in der absteigenden Reihenfolge der Infektions-/Todesfälle in EU / Europ. Wirtschaftsraum für 2015):
- 3. Generation Cephalosporin-resistente Escherichia coli (CRE)
- Methicillin-resistenter Staphylococcus aureus (MRSA)
- Carbapenem-resistenter Pseudomonas aeruginosa
- 3. Generation Cephalosporin-resistente Klebsiella pneumoniae
- Carbapenem-resistenter Acinetobacter spp
- Carbapenem-resistente Klebsiella pneumoniae
- Vancomycin-resistente Enterococcus faecalis und Enterococcus faecium (VRE)
(incl. der gramnegativen Spezies, zu „Extended-Spectrum-ß-Lactamasen (ESBLs) produzierenden Bakterien“ gehörend)
Infektionen durch MRE (darunter MRSA-/VRE-/ESBL-Infektionen) stellen weltweit ein schwerwiegendes Gesundheitsproblem dar. Als MRSA (Methicillin-resistenter Staphylococcus aureus) werden alle Staphylococcus aureus-Stämme bezeichnet, die eine Resistenz gegen Beta-Lactam-Antibiotika entwickelt haben. Zu diesen Antibiotika zählen Penicilline (z.B. Methicillin, Dicloxacillin, Nafcillin und Oxacillin) und Cephalosporine. VRE steht für Vancomycin-resistente Enterokokken (Vancomycin gehört zu den Antibiotika der Glykopeptid-Gruppe), ESBL steht für „Extended (Erweitertes) Spectrum Beta-Lactamase“-bildende Darmbakterien, die Beta-Lactam-basierte Antibiotika angreifen.
Nach Angaben des European Centre for Disease Prevention and Control (ECDC) ist MRSA derzeit für über 21 % der krankenhausbedingten Staphylococcus-Infektionen (2015) verantwortlich. Nach dem Cephalosporin (3. Generation)-resistenten E. coli ist MRSA der in Europa zweithäufigste für Krankenhausinfektionen verantwortliche Krankheitserreger. Alle diese Multi-Resistenz-bedingten Infektionen verursachen in der EU geschätzte 33.110 Todesfälle und 874.541 durch Behinderungen verloren gegangene Lebensjahre (disability-adjusted life years = DALYs).6 Eine sehr aktuelle Übersicht der fünf Hauptgründe für Erkrankungen, aus denen DALYs hervorgehen, findet sich bei Kyu et al. 2018.7
MRSA ist in Krankenhäusern und Pflegeeinrichtungen besonders problematisch, da dort Patienten mit offenen Wunden, invasiven Behandlungen und geschwächtem Immunsystem einem höheren Risiko für Infektionen ausgesetzt sind als die allgemeine Bevölkerung.
Der von Ducel (19958) beschriebene Blick in die Zukunft
„Nosokomiale Infektionen sind weit verbreitet. Sie tragen in hohem Maße zu Morbidität und Mortalität bei. Ihre Bedeutung als öffentliches Gesundheitsproblem wird weiter zunehmen, da ihre Auswirkungen auf die Menschen und die Wirtschaft aus folgenden Gründen immer stärker zu spüren sind:
- steigende Bevölkerung und Bevölkerungsdichte
- häufigeres Vorkommen von Immundefekten (Alter, Krankheit und Therapien)
- neue Mikroorganismen
- steigende Antibiotikaresistenz von Bakterien“
gibt heute, nach gut 25 Jahren, die Wirklichkeit überraschend genau wieder.
Wussten Sie schon?
Ursachen
Eine Kontamination kann auftreten, wenn Krankheitserreger unbeabsichtigt von einer Quelle in eine natürliche oder künstliche Körperöffnung des Wirts gelangen, sich dort vermehren und ihre schädigende Wirkung ausüben.
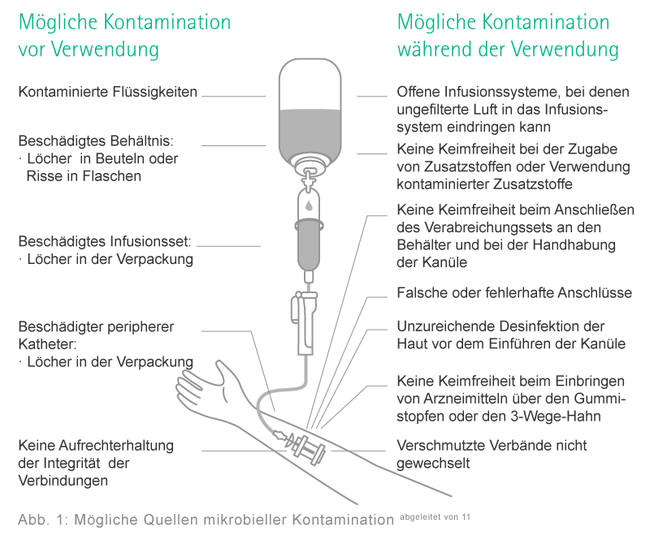
Mögliche Quellen, Eintrittsstellen und Übertragungswege
Wie kommt es zu einer Kontamination?
- Quellen: Natürliche oder künstliche Körperöffnungen, durch Verletzung oder Krankheit verursacht
- Eintrittsstellen: Natürliche oder künstliche Körperöffnungen, durch Verletzung oder Krankheit verursacht
- Direkte Übertragung durch Kontakt- oder Tröpfcheninfektion
- Indirekte Übertragung über Oberflächen oder Instrumente
- Indirekte Übertragung durch Vektoren, wie z. B. Mücken, Fliegen oder Ratten, die die Infektion übertragen
- Indirekte Übertragung durch einen Zwischenwirt wie beispielsweise Menschen, Tiere oder Insekten (z. B. Übertragung von Malaria durch Mücken)
Wichtige Kontaminations- und Übertragungswege in medizinischen Versorgungseinrichtungen sind die Hände des Personals und die Übertragung via Tröpfchen in der Luft
Infusionsbedingte Infektionen
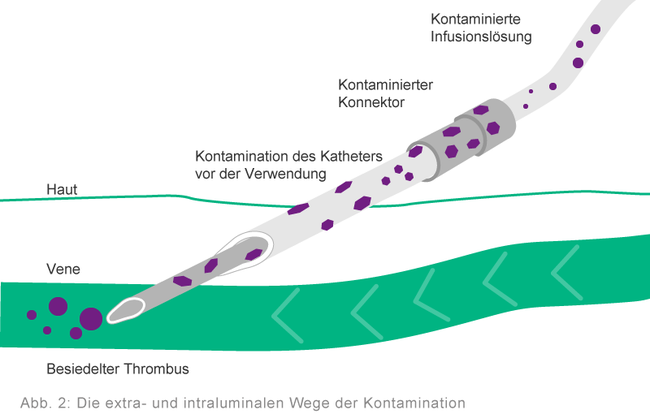
Zu einer Kontamination von Infusionssystemen kann es kommen, wenn Erreger in das Infusionssystem eingebracht werden. Dies geschieht meist während der Arbeit an bzw. mit den Systemen.
Bei infusionsbedingten Infektionen werden zwei Kontaminationswege unterschieden: extraluminal und intraluminal. Die intraluminale Kontamination ist die Folge einer unsachgemäßen Handhabung des Infusionssystems, z. B. des Katheteransatzstücks bei der Konnektion und Diskonnektion des Infusionsbestecks. Sie ist die häufigste Ursache von Katheterinfektionen, die ca. eine Woche nach dem Legen des Katheters
auftreten. 12, 13
Gesundheitliche Konsequenzen
Nosokomiale Infektionen treten weltweit auf und betreffen sowohl Industrienationen als auch ressourcenarme Länder. Sie zählen zu den häufigsten Todesursachen stationär behandelter Patienten und tragen erheblich zu der erhöhten Morbidität dieser Patienten bei. Sie stellen sowohl für die Patienten als auch für die öffentliche Gesundheit eine erhebliche Belastung dar. Eine Prävalenzstudie, die 2002 unter der Leitung der WHO in 55 Krankenhäusern in 14 Ländern aus 4 WHO-Regionen (Europa, östlicher Mittelmeerraum, Südostasien, Westpazifik) durchgeführt wurde, zeigte, dass durchschnittlich 8,7 % der stationär behandelten Patienten eine nosokomiale Infektion hatten. Weltweit leiden zu jedem Zeitpunkt über 1,4 Millionen Menschen an den Komplikationen einer Krankenhausinfektion.14
Auf Europa bezogen und aktueller (2014) rangierte der Prozentsatz invasiver MRSA-Isolate zwischen 0,9% in den Niederlanden und 56% in Rumänien und lag in 7 der 29 EU-Länder noch über 25%.15 (S. 63/64)
Diese Infektionen treten weltweit sowohl in Industrienationen als auch in Entwicklungsländern auf. Da sie während eines Krankenhausaufenthalts auftreten, verursachen sie verlängerte Liege- und Krankheitszeiten und erhöhte finanzielle Belastungen.
Es handelt sich bei den häufigsten nosokomialen Infektionen um katheterassoziierte Blutbahninfektionen (CLABSI), katheterassoziierte Harnwegsinfektionen (CAUTI), chirurgische Wundinfektionen (SSI) und beatmungsassoziierte Pneumonien (VAP).16
Gemäß einer Schätzung der WHO leiden ca. 15% aller hospitalisierten Patienten unter diesen Infektionen17, und Patienten auf Intensivstationen, in Verbrennungskliniken, in Organ-Transplantations-Einheiten sowie Neonatologie-Kliniken sind besonders betroffen: die EPIC II-Studie18 (Extended Prevalence of Infection in Intensive Care) berichtet, dass der Anteil infizierter Patienten auf Intensivstationen oft bis zu 51% erreicht.18, 19 Die Häufigkeit aller Infektionen in Ländern mit niedrigem Einkommen ist höher als in Ländern mit hohem Einkommen.19, 20
Eine Kontamination und eine daraus resultierende Infektion kann lokal oder systemisch auftreten:
- Eine lokale Infektion kann sich als postoperative Wundinfektion, Hautreizung oder Infektion an der Kathetereintrittsstelle manifestieren.
- Bei einer systemischen Infektion, bei der die Erreger in den systemischen Kreislauf gelangen, kann es zu Septikämie, Sepsis und septischem Schock kommen. Außerdem können Pathogene in Organe oder Extremitäten transportiert werden und Organinfektionen und Organversagen verursachen. Mögliche weitere Folgen sind z. B. Phlebitis21 oder Osteomyelitis.22
In allen Fällen sind zusätzliche diagnostische Maßnahmen und Behandlungen notwendig, die für die Patienten Unannehmlichkeiten und eine emotionale Belastung bedeuten und potenziell mit Nebenwirkungen und Schmerzen verbunden sein können. In manchen Fällen können sogar invalidisierende Folgen eintreten, die die Lebensqualität beeinträchtigen. Gleichzeitig verlängert sich unter Umständen die Verweildauer im Krankenhaus.
In der oben bereits erwähnten Studie EPIC II 17, 18 zur Punktprävalenz von Infektionen, die am 8. Mai 2007 bei schwerkranken Patienten durchgeführt wurde, wurde der Einfluss einer Methicillin-Resistenz auf das Überleben von Patienten mit Staphylococcus-aureus-Infektion untersucht. Am Stichtag der Studie wurden 7.087 (51 %) der 13.796 Patienten als infiziert eingestuft. Von diesen hatten 494 Patienten eine Infektion mit MRSA und 505 Patienten eine Infektion mit MSSA (Methicillin-sensitiver Staphylococcus aureus). Die Sterblichkeitsraten auf Intensivstationen betrugen 29,1 % bzw. 20,5 % und die entsprechenden Krankenhaussterblichkeitsraten 36,4 % bzw. 27,0 %.
Mittlerweile hat laut der ECDC MRSA europaweit nach den CRE (3. Gen. Cephalosporin-resistenter E. coli) den zweiten Platz eingenommen, und für Deutschland sind 54.509 Infektionsfälle-Fälle sowie 2.363 Todesfälle bedingt durch die 16 relevantesten Antibiotika-resistenten Bakterien dokumentiert– die Autoren konstatieren, dass die Bürde der Antibiotika-Resistenz-bedingten Bakterien in Europa substantiell zugenommen hat.6
Finanzielle Auswirkungen
Wirtschaftliche Auswirkungen nosokomialer Infektionen am Beispiel von MRSA
Auf Grundlage einer „Analyse von MRSA-zurechenbaren Kosten von hospitalisierten Patienten in Deutschland“ wurden die durchschnittlichen MRSA-zurechenbaren Kosten mit ca. 8.673 € pro Fall berechnet, wovon die sog. Opportunitätskosten 77,45% ausmachen.23
Weitere Kostenbeiträge in diesem Zusammenhang sind in der folgenden Abbildung 3 dargestellt: 23
| Kostenverteilung | Durchschnittliche Kosten pro Tag in Isolation, in € | Durchschnittliche Kosten pro Fall, in € |
| Arbeitsaufwand | 64,71 | 1,105,25 |
| Verbrauchsmaterialien | 43,75 | 747,25 |
| Hygienemanagement | 108,46 | 1.852,50 |
| Labor | 6,04 | 103,10 |
| Isolation (Belegte Betten) | 329,97 | 5.635,91 |
| Aufenthaltsdauer | 1.081,53 | |
| Opportunitätskosten | 6.717,44 | |
| Summe | 444,47 | 8.673,04 |
Abb. 3: Die Summe der genannten Kostensätze für Arbeitsaufwand und Verbrauchsmaterialien ergibt die Kosten für das Hygienemanagement. Die Summe der Kosten für die Isolation (Belegte Betten) und die Aufenthaltsdauer bilden die Opportunitätskosten.
Für die USA geben Roberts24 – allerdings nicht nur für MRSA, sondern für Krankenhaus-assoziierte Infektionen insgesamt - zurechenbare Kosten von 9.310 bis 21.013 USD an.
Ein akutes Auftreten nosokomialer Infektionen („Ausbruch“) kann die Kosten auf Millionenhöhe steigen lassen, wie von Karchmer (USA; 2002) für zwei Ausbrüche auf Neugeborenen-Intensivstationen geschildert, die 15 Tote forderten, mit zurechenbaren Kosten von 1.306.600 USD.25
Längere Krankenhausaufenthalte erhöhen nicht nur die direkten Kosten für die Patienten bzw. Kostenträger, sondern auch die indirekten Kosten, die durch Arbeitsausfall verursacht werden. Die notwendige Isolierung, zusätzliche Laboruntersuchungen sowie weitere diagnostische Maßnahmen erhöhen die Kosten weiter.
Nosokomiale Infektionen verstärken das Ungleichgewicht bei der Ressourcenverteilung auf die primäre und sekundäre medizinische Versorgung, indem die ohnehin knappen Finanzmittel für die Behandlung potenziell vermeidbarer Erkrankungen verwendet werden.
Auch nicht tödlich verlaufende Fälle mikrobieller Kontamination erfordern zusätzliche diagnostische Maßnahmen (z. B. Blutkulturen, Laborarbeiten, Röntgen) und therapeutische Maßnahmen (z. B. Antibiotika, Katecholamine) und führen zu einer längeren Verweildauer im Krankenhaus und Erhöhung der mittleren Tageskosten der zu erwartenden klinischen Behandlung.26, 27
Risikobedingte Kosten für die medizinische Versorgungseinrichtung
Patienten mit schwerer Infektion und Sepsis werden in der Regel auf einer Intensivstation behandelt. Da die Kosten der Intensivpflege zu einem großen Teil Fixkosten sind, hängen die Gesamtkosten für die Intensivversorgung hauptsächlich von der Verweildauer auf der Intensivstation ab. Diese Patienten benötigen eine längere Verweildauer auf der Intensivstation, was höhere Behandlungskosten im Vergleich zu anderen Intensivpatienten zur Folge hat: Laut USA-Studien wurden 2004 direkte Sepsis-bezogene Krankheitskosten auf 34.000 Euro geschätzt28. Im Vergleich dazu fielen die Kostenschätzungen in europäischen Studien geringer aus und lagen zwischen 23.000 und 29.000 Euro. 28 Allerdings machten die direkten Kosten lediglich etwa 20‑30 % der Krankheitskosten bei schwerer Sepsis aus, während 70‑80 % der Kosten auf indirekte Kosten entfielen, die größtenteils durch den Produktivitätsverlust aufgrund der Mortalität verursacht wurden.
Eine aktuelles systematisches Review zu Krankenhaus- bezogenen Kosten bei Sepsis29 hat auf Basis von 37 ausgewählten Studien die mittleren Kosten einer Sepsis pro Patient mit 32.421 USD sowie die mittleren Kosten auf der Intensivstation mit 27.461 USD errechnet – allerdings wird die Qualität der ausgewerteten Studien als „niedrig“ bezeichnet – insofern sind solche Kostenabschätzungen stets mit großer Vorsicht zu betrachten.
Präventionsstrategien
Die Prävention mikrobieller Kontaminationen und daraus resultierender nosokomialer Infektionen hat vor dem Hintergrund der dramatischen gesundheitlichen und wirtschaftlichen Folgen in den vergangenen Jahren immer mehr an Bedeutung und Aufmerksamkeit gewonnen. Fachgesellschaften, Krankenhäuser und Aufsichtsbehörden haben die Entwicklung evidenzbasierter Leitlinien für die Prävention nosokomialer Infektionen voran getrieben.3, 5, 30, 31, 32, 33
Aufklärung, Unterrichtung und Unterweisung
Die wichtigsten Maßnahmen der Infektionsprävention sind die Aufklärung und Schulung des medizinischen Fachpersonals. Dabei sind die notwendigen Kenntnisse, Fähigkeiten und Verhaltensweisen für die Umsetzung guter Praktiken zur Vermeidung nosokomialer Infektionen (NI) zu vermitteln. Benötigt werden Programme zur Schaffung eines Gefahrenbewusstseins und Weiterbildungs- und Ausbildungsmaßnahmen am Arbeitsplatz mit regelmäßigen Wiederholungsschulungen bzw. Personaleinweisungen sowie Surveillances (z.B. durch dokumentierte Befragungen oder das in Deutschland etablierte „Krankenhaus Infektions Surveillance System“ (KISS)).30 - 35
Unter allen Maßnahmen hat die Händehygiene den größten Einfluss auf die Infektionsprävention. Handschuhe und andere Schutzausrüstung sollten immer getragen werden. Ausgehend von der WHO und CDC, die weltweit Kampagnen für die Händehygiene gestartet haben, gibt es in Deutschland seit 2008 die „Aktion Saubere Hände“, die mit Postern, Schulungen, Websites und Leitlinien für die richtige Händehygiene wirbt.36 Korrekt durchgeführte Maßnahmen der Händehygiene können die MRSA-Raten erheblich reduzieren.37
Überwachung und Surveillance
Die Einführung von Überwachungssystemen auf Intensivstationen und für andere Risikopatientengruppen, mit denen die infektionsbedingten Komplikationsraten bestimmt, Trends erkannt und Fehler bei der Infektionsprävention korrigiert werden sollen, hat sich als erfolgreich erwiesen. So konnte beispielsweise in den Niederlanden die MRSA-Prävalenz mithilfe der Strategie zur Surveillance von Infektionen auf unter 1 % von allen klinischen Isolaten reduziert werden und ist damit die niedrigste weltweit. 38 - 40
Technische Lösungsansätze
- Verwendung steriler Einwegprodukte
- Verwendung geschlossener Systeme und Geräte, die keinen Austausch ungefilterter Luft oder Verunreinigungen mit der Umgebung zulassen.41
- Verwendung durchsichtiger Pflaster zum Fixieren der Kanüle/des Katheters
- Handelsübliche Infusionslösungen werden steril hergestellt und geliefert. Eine Kontamination von Infusionslösungen geschieht selten während des Herstellungsprozesses, sondern eher während der Arbeit mit den Lösungen und der manuellen Zubereitung von Arzneimitteln.42
Empfehlungen für den Umgang mit Materialien für die intravenöse Infusion
- Alle Behälter für intravenöse Lösungen müssen vor Zubereitung und Verwendung sorgfältig auf Risse, Defekte, Trübung und Partikel untersucht werden.
- Venenkatheter dürfen niemals erneut eingeführt werden.
- Routinemäßiger Austausch des Infusionsbestecks gemäß CDC, hausinterner oder institutioneller Vorgaben.43
- Infusionssysteme so wenig wie möglich beeinflussen und berühren, da jede Manipulation ein Kontaminationsrisiko darstellt.
- Es muss, wann immer dies möglich ist, ein Maximum an sterilen Barrieren verwendet werden.
Produktempfehlung zur Risikoprävention
Literaturangaben
1 Ghiglione JF, Martin-Laurent F, Pesce S. (2015) Microbial ecotoxicology: an emerging discipline facing contemporary environmental threats. Environ Sci Pollut Res; DOI 10.1007/s11356-015-5763-1
2 Gabriel J. (2008) Infusion therapy. Part two: Prevention and management of complications. Nurs Stand; 22(32): 41-8 doi: 10.7748/ns2008.04.22.32.41.c6447
3 World Health Organization (WHO) https://www.who.int/gpsc/country_work/burden_hcai/en/, (Zugriff: 06.2021)
4 Guembe M, Martín-Rabadán P, Echenagusia A, Camúñez F, Rodríguez-Rosales G, Simó G, Echenagusia M, Bouza E. (2012) How should long-term tunneled central venous catheters be managed in microbiology laboratories in order to provide an accurate diagnosis of colonization? J Clin Microbiol; 50(3):1003-7
5 O‘Grady NP, Alexander M, Dellinger EP, Gerberding JL, Heard SO, Maki DG, Masur H, McCormick RD, Mermel LA, Pearson ML, Raad II, Randolph A, Weinstein RA. Guidelines for the prevention of intravascular catheter-related infections Infect Control Hosp Epidemiol. 2002 Dec; 23(12):759-69
6 Cassini et al. (2018) Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect Dis. 2019 Jan; 19(1):56-66. doi: 10.1016/S1473-3099(18)30605-4. Epub 2018 Nov 5. (European Centre for Disease Prevention and Control (ECDC)
7 Kyu et al. Global, regional, and national disability-adjusted life-years (DALYs) for 359 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017, The Lancet, 10.11.2018, 392 (10159): 1859–1922. doi:10.1016/S0140-6736(18)32335-3
8 Ducel G. (1995) Les nouveaux risques infectieux. Futuribles 203:5–32 https://www.futuribles.com/en/revue/203/les-nouveaux-risques-infectieux, (Zugriff: 06.2021)
9 Pittet D (2016) Adapt to Adopt TEDxPlaceDesNations. https://www.youtube.com/watch?v=5tgH0uTqqcE, (Zugriff: 06.2021)
10 WHO Presentation: WHO_Facts_DRT661. Health-Care Associated Infection and Hand,
Hygiene Improvement – Slides for the Hand Hygiene Coordinator of the WHO”. http://www.who.int/gpsc/country_work/gpsc_ccisc_fact_sheet_en.pdf (Zugriff: 06.2021)
11 Jamieson EM, McCall JM, Whyte LA. Practice 21: Intravenous therapy. In: Jamieson EM, McCall JM, Whyte LA. Clinical nursing practices. 5. Edition, Edinburgh [u.a.]: Elsevier Churchill Livingstone 2007; 169-176
12 Shah H, Bosch W, Thompson KM, Hellinger WC. (2013) Intravascular catheter-related bloodstream infection. Neurohospitalist; 3(3): 144-51
13 Rosado V, Romanelli RM, Camargos PA. (2011) Risk factors and preventive measures for catheter-related bloodstream infections. J Pediatr (Rio J); 87(6): 469-77
14 World Health Organization. (2002). Prevention of hospital-acquired infections : a practical guide / editors : G. Ducel, J. Fabry and L. Nicolle, 2nd. ed. Geneva, Switzerland : World Health Organization. https://apps.who.int/iris/handle/10665/67350, (Zugriff: 06.2021)
15 European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe in 2014. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC; 2015. http://ecdc. europa.eu/en/publications/Publications/antimicrobial-resistance-europe- 2014.pdf, (Zugriff: 06.2021)
16 Sydnor ERM & Perl TM. Hospital epidemiology and infection control in acute-care settings. Clin Microbiol Rev, 24 (1) (2011), 141-173
17 Khan, Hassan Ahmed; Baig, Fatima Kanwal; Mehboob, Riffat (2017): Nosocomial infections. Epidemiology, prevention, control and surveillance. In Asian Pacific Journal of Tropical Biomedicine 7 (5), pp. 478–482. DOI: 10.1016/j.apjtb.2017.01.019
18 Hanberger H, Walther S, Leone M, Barie PS, Rello J, Lipman J, Marshall JC, Anzueto A, Sakr Y, Pickkers P, Felleiter P, Engoren M, Vincent JL; EPIC II Group of Investigators. (2011) Increased mortality associated with methicillin-resistant Staphylococcus aureus (MRSA) infection in the intensive care unit: results from the EPIC II study. Int J Antimicrob Agents; 38(4): 331-5
19 Vincent JL, Marshall J, Silva E, Anzueto A, Martin CD, Moreno R et al. International study of the prevalence and outcomes of infections in intensive care units. JAMA, 302 (21) (2009), 2323-2329.
20 Nejad SB, Syed SB, Ellis B & Pittet D. Health-care-associated infection in Africa: a systematic review. Bull World Health Org, 89 (2011), 757-765
21 Uslusoy, E & Mete S. Predisposing Factors to Phlebitis in Patients with Peripheral Intravenous Catheters: A Descriptive Study. J Am Acad Nurse Pract 2008; 20(4):172-80, https://pubmed.ncbi.nlm.nih.gov/18387013/ (2008), (Zugriff: 06.2021)
22 Bouchoucha S, Benghachame F, Trifa M, Saied W, Douira W, Nessib MN, Ghachem MB. (2010) Deep venous thrombosis associated with acute hematogenous osteomyelitis in children. Orthop Traumatol Surg Res; 96(8): 890-3
23 Hübner C, Hübner N-O, Hopert K, Maletzki S, Flessa S Analysis of MRSA-attributed costs of hospitalized patients in Germany Eur J Clin Microbiol Infect Dis 2014 doi: 10.1007/s10096-014-2131-x
24 Roberts RR et al. Costs attributable to healthcare-acquired infection in hospitalized adults and a comparison of economic methods Med Care 2010 Nov; 48 (11):1026-1035 https://www.ncbi.nlm.nih.gov/pubmed/20940650, (Zugriff: 06.2021)
25 Karchmer TB, Durbin LJ, Simonton BM, Farr BM. Cost-effectiveness of active surveillance cultures and contact/droplet precautions for control of methicillin-resistant Staphylococcus aureus. J Hosp Infect. 2002 Jun; 51(2):126-32
26 Gianino MM, Vallino A, Minniti D, Abbona F, Mineccia C, Silvaplana P, Zotti CM. A method to determine hospital costs associated with nosocomial infections (transl). Ann Ig., 2007; 19(4): 381-92
27 Bertolini G, Confalonieri M, Rossi, Simini B, Gorini M, Corrado A. Cost of the COPD. Differences between intensive care unit and respiratory intermediate care unit. Res Med 2005(99): 894-900
28 Burchardi H, Schneider H. Economic Aspects of Severe Sepsis: A Review of Intensive Care Unit Costs, Cost of Illness and Cost effectiveness of Therapy. Adis International, PharmacoEconomics 2004; 22(12): 793-813(21).
29 Arefian H & Hartmann M „Hospital-related cost of sepsis: A systematic review. Journal of Infection Vol. 74, Issue 2, February 2017, Pages 107-117 -> https://www.ncbi.nlm.nih.gov/pubmed/27884733, (Zugriff: 06.2021)
30 MMWR Morbidity and Mortality Weekly Report. 2002 Morbidity and Mortality Weekly Report. Guideline for Hand Hygiene in Health-Care Settings. Recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. Recommendations and Reports, Oct 25, 2002, (51) No. RR-16
31 Gastmeier P, Geffers C, Brandt C, Zuschneid I, Sohr D, Schwab F, Behnke M, Daschner F, Rüden H. (2006) Effectiveness of a nationwide nosocomial infection surveillance system for reducing nosocomial infections. J Hosp Infect; 64(1): 16-22
32 Zingg W, Holmes A, Dettenkofer M, Goetting T, Secci F, Clack L, Allegranzi B, Magiorakos AP, Pittet D; systematic review and evidence-based guidance on organization of hospital infection control programmes (SIGHT) study group. (2015) Hospital organisation, management, and structure for prevention of health-care-associated infection: a systematic review and expert consensus. Lancet Infect Dis. 2015; 15(2): 212-24
33 Sax H, Clack L, Touveneau S, Jantarada Fda L, Pittet D, Zingg W; PROHIBIT study group. (2013) Implementation of infection control best practice in intensive care units throughout Europe: a mixed-method evaluation study. Implement Sci; 8: 24
34 World Health Organization. 2009 World Health Organization. WHO Guidelines on Hand Hygiene in Health Care. WHO Library Cataloguing-in-Publication Data
35 Kramer A, Wagenvoort H, Ahrén C, Daniels-Haardt I, Hartemann P, Kobayashi H, Kurcz A, Picazo J, Privitera G, Assadian O. Epidemiology of MRSA and current strategies in Europe and Japan. Institute for Hygiene and Environmental Medicine, University Greifswald, Germany, GMS Krankenhyg Interdiszip. 2010 Feb 10; 5(1): Doc01
36 Robert Koch-Institut. „Aktion Saubere Hände“: Keine Chance den Krankenhausinfektionen! Epidemiologisches Bulletin 22. August 2008 / Nr. 34
37 WHO 2014: Evidence of hand hygiene to reduce transmission and infections by multidrugresistant organisms in health-care settings: A SYSTEMATIC LITERATURE REVIEW.
https://www.who.int/gpsc/5may/MDRO_literature-review.pdf?ua=1, (Zugriff: 06. 2021)
38 Grayson ML, Jarvie LJ, Martin R, Johnson PD, Jodoin ME, McMullan C, Gregory RH, Bellis K, Cunnington K, Wilson FL, Quin D, Kelly AM Significant reductions in methicillin-resistant Staphylococcus aureus bacteraemia and clinical isolates associated with a multisite, hand hygiene culture-change program and subsequent successful statewide roll-out. Med J Aust. 2008 Jun 2;188(11):633-40 https://www.ncbi.nlm.nih.gov/pubmed/18513171, (Zugriff: 06. 2021)
39 Wertheim HF, Vos MC, Boelens HA, Voss A, Vandenbroucke-Grauls CM, Meester MH, Kluytmans JA, van Keulen PH, Verbrugh HA: Low prevalence of methicillin-resistant Staphylococcus aureus (MRSA) at hospital admission in the Netherlands: the value of search and destroy and restrictive antibiotic use. J Hosp Infect 2004 Apr; 56(4): 321-5
40 van der Hoeck G. Sustained low prevalence of methicillin-resistant Staphylococcus aureus upon admission to hospital in the Netherlands. Very low prevalence of MRSA in Dutch population at hospital admission-Study. J Hosp Infect. 2011 Jul 13
41 CDC-NIOSH ALERT 2004 – Preventing Occupational Exposures to Antineoplastic and Other Hazardous Drugs in Health Care Settings https://www.cdc.gov/niosh/docs/2004-165/default.html , https://www.cdc.gov/niosh/topics/hazdrug/CSTD.html (Zugriff: 06. 2021)
42 Scales K. Vascular access: a guide to peripheral venous cannulation. Nurs Stand. 2005; 19(49): 48-52
43 Keay S & Callander C The safe use of infusion devices. Continuing Education in Anaesthesia, Critical Care & Pain, Vol. 4 No. 3 2004 – doi 10.1093/bjaceaccp/mkh022