Postoperative Wundinfektionen
Unter einer postoperativen Wundinfektion versteht man eine Infektion, die nach einer Operation im Bereich der Operationsstelle entsteht. Sie kann oberflächlich auftreten und nur die Haut betreffen. Andere Infektionen sind schwerwiegender und können die Gewebeschichten unter der Haut, Organe oder Implantate angreifen. Die Weltgesundheitsbehörde WHO hat festgestellt, dass postoperative Wundinfektionen jedes Jahr das Leben von Millionen Patienten gefährden und zur Verbreitung von Antibiotikaresistenzen beitragen.
Wussten Sie schon?

(1) WHO. (2016). Hand Hygiene and the Surgical Patient Journey. http://www.who.int/gpsc/5may/EN_PSP_GPSC1_5May_2016/en/ (acc. 02/2017).
(2) WHO. (2011). Report on the Burden of Endemic Health Care-Associated Infection Worldwide. WHO: Geneva.
(3) Wiseman JT. Predictors of Surgical Site Infection after Hospital Discharge in Patients Undergoing Major Vascular Surgery. J Vasc Surg. 2015 Oct; 62(4): 1023–1031.e5.
(4) CDC. (2009). Surgical Site Infection (SSI) Toolkit. http://www.cdc.gov/HAI/ssi/ssi.html (acc. 08/2016).
(5) Centers for Disease Control and Prevention (CDC). April 2015. http://www.cdc.gov/nhsn/PDFs/pscManual/9pscSSIcurrent.pdf (acc. 02/2017)
(6) http://www.who.int/gpsc/5may/hh_infographic_A3_EN.pdf?ua=1 (acc. 02/2017)
Ursachen
Postoperative Wundinfektionen zählen zu den Infektionsarten, die behandlungsbezogen oder durch Medizinprodukte hervorgerufen werden. Sie können durch die Übertragung pathogener Mikroorganismen in der gleichen Umgebung, zwischen Patienten und zwischen Patienten und Pflegepersonal entstehen.
Durch die invasiven Abläufe in der Chirurgie und der Exposition mit Blut, Körperflüssigkeiten und Gewebe ist das Risiko hoch, Pathogene zu übertragen und steht im direkten Zusammenhang mit den Gegebenheiten des Operationsbereichs, des Patienten, des OP-Teams und der Art des chirurgischen Eingriffs.
SSI sind die häufigste Komplikation bei chirurgischen Patienten und für 38 % aller Infektionen verantwortlich. Das Patientenrisiko, eine postoperative Wundinfektion zu erlangen, ist hauptsächlich vom Immunsystem abhängig und dessen Fähigkeit Mikroorganismen, die den Operationsbereich kontaminiert haben, zu bekämpfen.3
„Durch das Auftreten postoperativer Wundinfektionen kann die Pflegequalität reflektiert werden, da sie potentiell vermeidbare Komplikationen darstellen, die in direktem Zusammenhang mit der Chirurgie stehen.“6 Richtlinien zur Vermeidung postoperativer Wundinfektionen gibt es bereits seit 1999.7,8,9
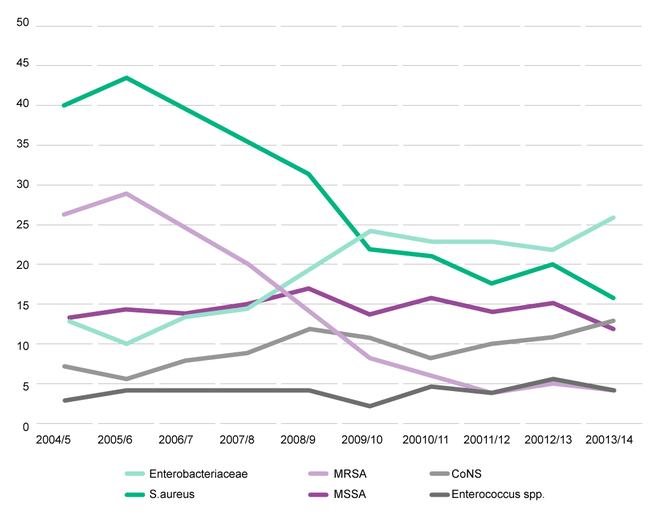
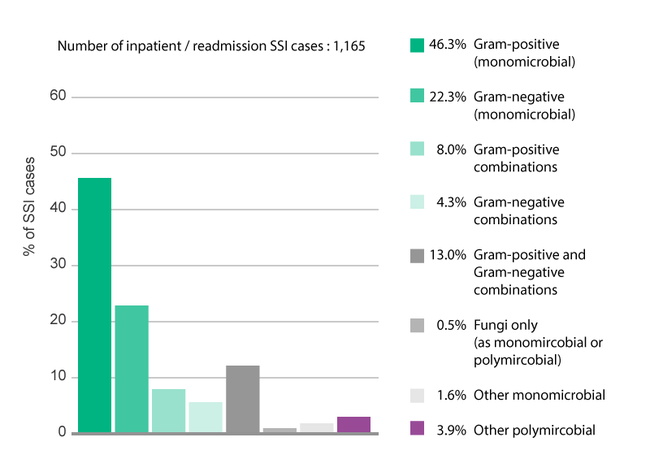
Abb. 2: Entwicklung der SSI-verursachenden Mikroorganismen (stat. Patienten), alle chirurgischen Kategorien (außer Brust-, Kranial-, Herz-(Non-CABG) Chirurgie, NHS Krankenhäuser in England [17]
Laut NSH zeigen Mikroorganismen, die SSI verursachen und durch Staphylococcus aureus hervorgerufen werden, zwischen 2004 und 2014 einen starken Abwärtstrend – bedingt durch den Rückgang von MRSA. Demgegenüber steht ein starker Anstieg von meist multiresistenten gramnegativen Enterobakterien. Der beschriebene Rückgang von MRSA in den Jahren 2013/2014 reflektiert die Auswirkungen/Effekte der Infektionspräventions-Initiativen, die zur Kontrolle von MRSA ins Leben gerufen wurden.3
Postoperative Wundinfektionen hängen von der Art des chirurgischen Eingriffs ab.17 Jüngere Patienten (<45 Jahren) haben bei Herzeingriffen (Non-CABG) das höchste Risiko einer postoperativen Wundinfektion, während ältere Patienten bei Eingriffen z. B. am Gallengang/Leber/Pankreas, CABG, Magen oder der Wirbelsäule ein höheres Risiko aufweisen. Bei Knie-Prothesen ist das Risiko in allen Altersgruppen vergleichbar. Die Risiko-Ursachen einer Patienteninfektion sind in Punkte-Skala-Bewertungssysteme klassifiziert, z. B. ASA-Score, Wundkategorie-Score oder BMI des Patienten.
Darüberhinaus wird berichtet, dass postoperative Wundinfektionen mit individuellen Risikofaktoren in Zusammenhang stehen, wie z. B. Diabetes, Zigarettenkonsum (und sein Einfluss auf die Wundheilung), Obesitas (in Verbindung mit Diabetes) und koinzidente weitere Infektionen oder Kolonisation.27,28
Während postoperative Wundinfektionen bei Patienten meist bakteriellen Ursprungs sind, werden Infektionen des Pflegepersonals häufiger durch Viren verursacht. 26 verschiedene Viren wurden für die Übertragung von pathogenen Keimen beschrieben.18 Das Risiko durch Blut übertragener Infektionen wie Hepatitis B (HBV), Hepatitis C (HCV) und das Humane Immundefizienz Virus (HIV) ist im Operationssaal am höchsten und eng mit den Arbeitsabläufen verknüpft. Die Einhaltung von Standard-Vorbeugemaßnahmen ist zum Schutz vor perkutanen Verletzungen unerlässlich.20 Chirurgen und Labor-Mitarbeiter tragen das höchste Risiko perkutaner Verletzungen.20,21,22 Ohne Post-Expositions-Prophylaxe oder adäquaten Impfschutz liegt das Risiko einer HBV-Infektion nach perkutaner Verletzung bei Mitarbeitern im Gesundheitswesen schätzungsweise bei bis zu 30 %.23
Die Richtlinie „Management of Healthcare Workers Who Are Infected with Hepatitis B Virus, Hepatitis C Virus, and/or Human Immunodeficiency Virus“ der Society for Healthcare Epidemiology of America SHEA kategorisiert das Risiko durch Blut übertragener Pathogene in 3 Risikoklassen, wobei offene und großflächige chirurgische Eingriffe als größtes Risiko eingestuft werden. SHEA spricht sich für eine umfassende Schulung aller medizinischen Mitarbeiter zu blutübertragenen Pathogenen aus.25
Perforation von Operationshandschuhen
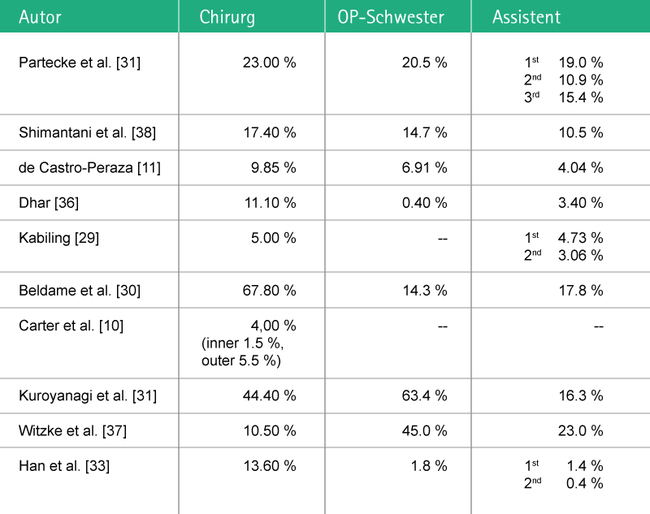
Das Auftreten chirurgischer Kreuzinfektionen steht in direktem proportionalem Zusammenhang mit perforierten Operationshandschuhen sowie der Dauer des chirurgischen Eingriffs.29 Das Risiko von Handschuhperforationen hängt stark vom Operationsverfahren ab und variiert von 3,58 % bei Hüftimplantationen30 bis zu 91,1 % in der Kieferchirurgie.31 Gemäß einer Studie von Partecke et al.32 birgt die Herz-Thorax-Chirurgie ein Risiko von 32,3 %, gefolgt von vaskulären Eingriffen mit 22,3 %, der Abdominalchirurgie (kleine, mittlere und große Eingriffe) mit 12,3 %-20,3 % und laparoskopischen Operationen mit 15,3 %. „Verglichen mit anderen klinischen Bereichen besteht in der orthopädischen Chirurgie aufgrund von scharfen knöchernen Oberflächen und dem Hantieren mit chirurgischen Instrumenten ein höheres Perforationsrisiko.“33
Die meisten Studien, die Handschuhperforationen bei OP-Teams untersuchen, zeigen, dass die Operateure dem höchsten Perforationsrisiko ausgesetzt sind. Allerdings belegen einige Studien auch, dass OP-Schwestern das höchste Risiko einer Handschuhperforation während des Eingriffs tragen (siehe Abb. 4).31,37
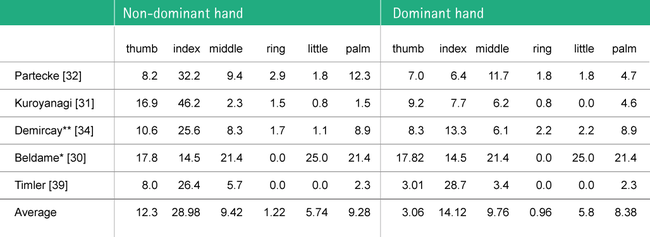
Die Perforationsstellen an beiden Händen von Chirurgen wurden in verschiedenen Studien quantifiziert; im Durchschnitt wurden die Handschuhe am Zeigefinger der nicht-dominanten Hand am häufigsten perforiert (siehe Abbildung 5).30,31,32,34,39
Neben dem Hantieren mit scharfen Instrumenten und mechanischen Belastungen kann die angewandte „Gloving-Methode“ ebenfalls zu Handschuhperforationen führen. Eine Studie, die 1537 Handschuhe nach 113 Operationen untersuchte, entdeckte 121 Perforationen, von denen lediglich 7 während des Eingriffs bemerkt wurden.11
Wird die doppelte Handschuh-Technik angewendet, verhält sich das relative Risiko einer Handschuhperforation vom unteren zum oberen Handschuh von 4,5 % zu 14,1 %.38
Bei einer Untersuchung von insgesamt 3.863 Handschuhen aus 58 Primär- und 36 Revisions-Eingriffen bei Total-Endoprothetischen-Eingriffen (TEP) wiesen 3,7 % der Chirurgen bei Primäreingriffen und 8,9 % der Chirurgen bei den Revisionseingriffen Perforationen an ihren oberen Handschuhen auf. Wurden beide Handschuhe perforiert, wurde der äußere Defekt zu 100 % intraoperativ bemerkt, während der Defekt des inneren Handschuhs nur zu 19 % entdeckt wurde.10 Laut der „Basel SSI Cohort Studie“12 erhöhen Handschuh-Perforationen ohne chirurgische antimikrobielle Prophylaxe das Risiko von postoperativen Infektionen beträchtlich.
Neben Standard-Handschuh-Verfahren sind die Erfahrung und Weiterbildung von Operateuren und OP-Personal weitere Faktoren, die helfen, das Risiko von postoperativen Wundinfektionen zu verringern.
Gesundheitliche Folgen
Während operativer Eingriffe besteht ein hohes Risiko der Übertragung von Krankheitserregern vom chirurgischen Personal auf Patienten und umgekehrt. Bei Patienten werden postoperative Wundinfektionen meistens durch Bakterien, in manchen Fällen auch durch Pilze verursacht. Diese Mikroorganismen führen zu Infektionen, die ernste und lebensbedrohliche Komplikationen hervorrufen können. Multiresistenzen schränken die Therapiemöglichkeiten ein.
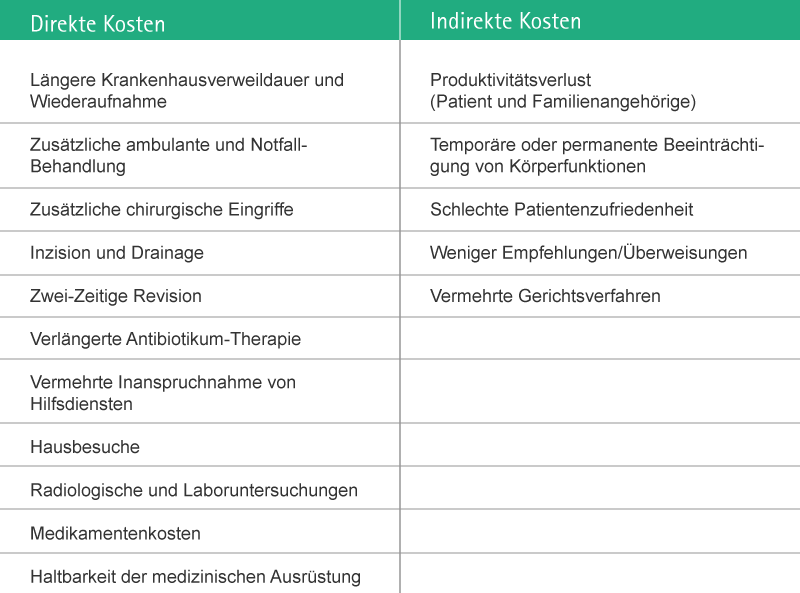
Daraus ergeben sich ein verlängerter Krankenhausaufenthalt und, abhängig von der Schwere der Infektion, weitere Therapien und zusätzliche erforderliche chirurgische Eingriffe.
Finanzielle Folgen
Potentielle risikobezogene Kosten
Unter Berücksichtigung des Operationsverfahrens und patientenbezogener Risikofaktoren, können die geschätzten Kosten pro SSI lt. Datenanalyse aus den 1990er Jahren von unter 400$ bis zu über 30.000$ variieren.41 Eine aktuellere Publikation bewertet die Daten aus 14 Studien aus den Jahren 2000-2009 und gibt Kosten von 3.859$ (Mittelwert) – 40.559$ (Mittelwert) pro SSI an.42
Das „Center of Disease Control and Prevention“ CDC schätzt die jährliche Anzahl postoperativer Wundinfektionen in den USA auf 300.000 – 3% davon mit tödlichem Verlauf, 7-10 zusätzlichen postoperativen Krankenhaustagen und Kosten von bis zu 10 Milliarden $.15 Das Erkennen postoperativer Wundinfektionen ist aufgrund der steigenden Anzahl ambulanter Operationen und kürzerer Krankenhausverweildauer schwierig, sodass die jährlichen Gesamtkosten sogar noch höher sein könnten.
Es gibt nur wenige Informationen über die Nachwirkungen postoperativer Wundinfektionen nach der Entlassung aus dem Krankenhaus, inkl. Wiederaufnahme, ambulante Behandlungen und Langzeitfolgen. Eine Beobachtung nach der Entlassung aus dem Krankenhaus im Gegensatz zur Nachverfolgung von Wiederaufnahmen ist für die Evaluierung von kurzen postoperativen Aufenthalten besonders wichtig.
Eine Studie (basierend auf Patientenbefragungen) zu postoperativen Wundinfektionen nach der Krankenhausentlassung berichtet von 1,9% bei 4.571 Behandlungen. Die durchschnittlichen Gesamtkosten über 8 Wochen nach der Entlassung von Patienten mit SSI betrugen 5.155$ im Vergleich zu 1.773$ bei der Kontrollgruppe.43
Die Übertragung von Krankheitserregern auf das medizinische Personal geschieht bei Nadelstichverletzungen während Operationen. Sicherheitskampagnen haben die Rate von Nadelstichverletzungen in den USA von 2001-2006 um 31,6 % sinken lassen, während die Anzahl der Nadelstichverletzungen im OP-Umfeld während des gleichen Zeitraums um 6,5 % anstieg. Das größte Risiko einer perkutanen Verletzung während chirurgischer Eingriffe liegt in der Verwendung chirurgischer Nahtmaterialien (siehe Abb. 8).44
Nadelstichverletzungen können verschiedene direkte und indirekte Kosten für die Gesundheitseinrichtung verursachen, u. a.
- Arbeitsunfähigkeit von Mitarbeitern
- Verletzungsbezogene Untersuchungen/Nachforschungen
- Laboruntersuchungen
- Behandlung infizierter Mitarbeiter
- Ersatz von Mitarbeitern
Die betroffenen Mitarbeiter und ihre Familien leiden unter den Umständen während der Untersuchungsperiode und unter der Stress-Situation, die die Behandlung und mögliche Folgen der Infektion mit sich bringen.
Abbildung 9 zeigt eine Schätzung der möglichen Zusatzkosten infolge von Komplikationen bei Nadelstichverletzungen.
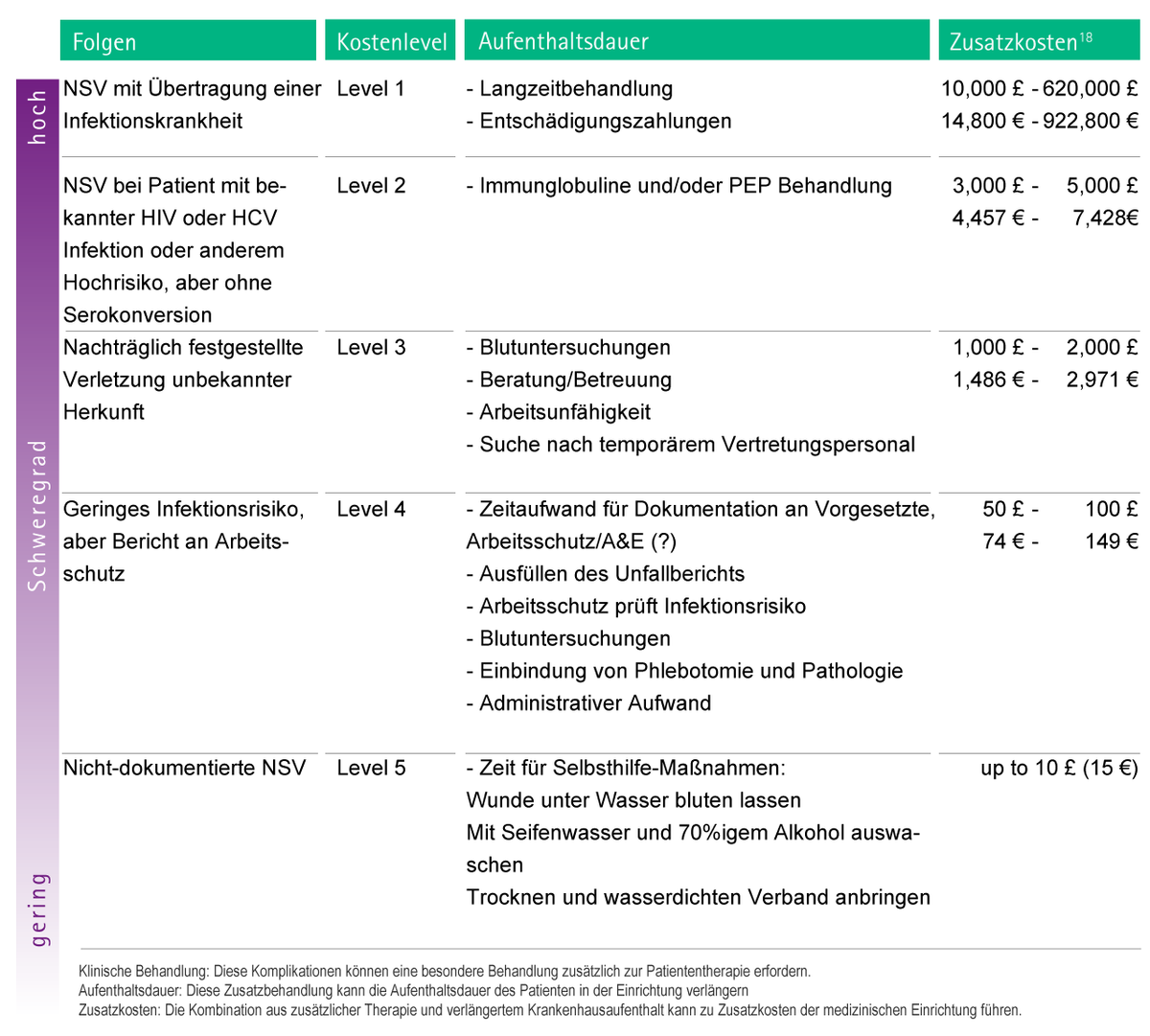
Abb. 9: Mit Nadelstichverletzungen assoziierte Kosten. Die Kosten sind in 5 Klassen gegliedert und die Anzahl der Nadelstichverletzungen ist aufsteigend von Level 1 bis 5. Schadensersatzzahlungen sind nicht explizit enthalten und müssen individuell hinzugerechnet werden.
Präventionsstrategien
Optimierte und standardisierte Handschuh-Verfahren sowie adäquate Schutzkleidung bilden die Grundlage zur Vermeidung von Risiken in der Chirurgie.48,49
Die „Basel SSI Cohort Study“ zeigt, dass postoperative Wundinfektionen für 14-16% aller nosokomialen Infektionen von stationären Patienten verantwortlich sind und dabei die am häufigsten vorkommende krankenhausbezogene Infektion in der Chirurgie darstellen. Postoperative Wundinfektionen sind vermeidbare Komplikationen und reflektieren deutlich die Pflegequalität und –leistung der medizinischen Einrichtungen. Die Einführung von „Double-Gloving-Verfahren“ sowie chirurgisches Training werden zur Reduzierung von SSI empfohlen.12
Double Gloving & Richtlinien zum Handschuhwechsel
Im OP-Prozess treten Handschuhperforationen vermehrt auf, je länger die Operation dauert. Meist bleiben sie unbemerkt. Daher empfiehlt sich die Implementierung von Standards zum Handschuhwechsel gemäß einer Risikoevaluierung unter Berücksichtigung der verschiedenen OP-Verfahren.
Allgemein wird ein Handschuhwechsel nach spätestens 90 Minuten empfohlen.9,32,36
In einem Simulationsmodell zeigte sich, dass beim Tragen von doppelten Handschuhen im Vergleich zu einer Einzelschicht Handschuhe nur 17 % des Blutes durch die Handschuhe drangen.53 Ein Enzym-Kontaminationsversuch ergab, dass eine doppelte Handschuhschicht punktions-resistenter war und mehr Enzymverunreinigungen von chirurgischen Nadeln abstreifen konnte als eine vergleichbar dicke Einzelschicht.54 Beim Entfernen der Schutzkleidung nach Operationen belegte eine experimentelle Studie einen signifikant niedrigeren Virentransfer auf die Hände, wenn doppelte Handschuhe getragen wurden.55
In einer klinischen Studie blieben in 4 von 5 Fällen die unteren Handschuhe unversehrt, während der obere Handschuh unbemerkt perforiert wurde.11
„OP-Teams müssen die erhöhte Sicherheit zu Lasten einer möglichen Unbequemlichkeit und reduzierten Tastsensibilität abwägen.“11
Entgegen dieser Aussage haben weitere Studien gezeigt, dass Double-Gloving keinen wesentlichen Einfluss auf die manuelle Geschicklichkeit oder taktile Sensibilität im Vergleich zu keinen Handschuhen oder Einzelhandschuhen hat.8,33,56
Das Double-Gloving Indikatorsystem mit einem dunklen unteren Handschuh und einem hellen oberen Handschuh hilft dabei, Perforationen im äußeren OP-Handschuh schnell und sicher zu identifizieren. Im Falle eines Flüssigkeitseintritts durch den äußeren OP-Handschuh wird umgehend ein dunkler Fleck sichtbar und der Handschuh kann sofort gewechselt werden. Dieses Indikatorsystem reduziert sowohl die Häufigkeit unbemerkter Perforationen wie auch das Risiko intraoperativer Kreuzinfektionen.37
Double-Gloving mit Indikatorsystem ist wesentlich effektiver als das Tragen nur einer Handschuhschicht, um das Risiko von Handschuhperforationen zu reduzieren. Außerdem bietet es mehr Schutz als das Standard Double-Gloving-Verfahren.7 „Erwiesenermaßen helfen die Verfahren des Double-Gloving und Indikator-Double-Gloving, das Risiko perkutaner Verletzungen zu senken und stellen daher eine wirksame Barriere gegen blutübertragene Krankheitserreger dar.“58
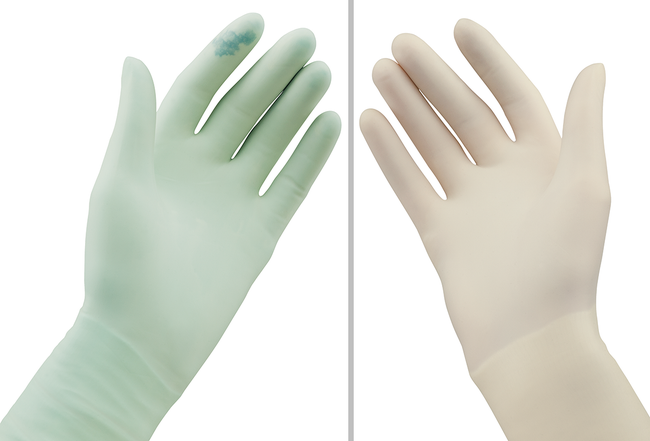
Abb. 11: Vergleichende Darstellung Double-Gloving mit grünem Indikatorhandschuh und 2 weißen OP-Handschuhen
Double-Gloving wird nicht nur als Standard-Verfahren für Operateure empfohlen, sondern dient ebenfalls dem Schutz von OP-Schwestern vor blutübertragenen Krankheitserregern.58 Während einer Laryngoskopie und Intubation reduziert sich die Kontamination der intra-operativen Umgebung signifikant, wenn der Anästhesist 2 Paar Handschuhe trägt und das äußere Paar unmittelbar nach der Intubation entfernt.59
Das letzte Review der COCHRANE Collaboration Group untersuchte bis Juni 2013 34 Studien, die insgesamt 6.890 operative Eingriffe umfassten und 17 Studien, die sich mit der Untersuchung von Double-Gloving-Standards befassten. Die Autoren schlussfolgerten, „dass belegt werden kann, dass Double-Gloving im Vergleich zum Single-Gloving während chirurgischer Eingriffe Perforationen und Blutflecken auf der Haut reduziert, was zu einem Rückgang perkutaner Verletzungen führt (…). Die Präventivwirkung von Double-Gloving-Verfahren auf perkutane Verletzungen bei Operationen muss nicht weiter untersucht werden.“8
Inzwischen wird das Double-Gloving-Verfahren von diversen Berufsorganisationen empfohlen, u. a.das Center for Disease Control and Prevention (CDC), die Association of periOperative Registered Nurses (AORN), der American Academy of Orthopedic Surgeons (AAOS), dem American College of Surgeons (ACS) und der WHO Patientensicherheit-Initiative für eine sichere Arbeitsumgebung. Checklisten und Hilfsmittel wurden entwickelt, um Compliance und Sicherheit zu erhöhen, wie z. B. SSI Toolkits des Amerikanischen Gesundheitsministeriums und des COC.15
Darüber hinaus wurden von der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) und der Gesellschaft für Virologie Empfehlungen für HIV-positive Mitarbeiter im Gesundheitswesen (HCW) herausgegeben:
„Bei einer permanenten viralen Belastung von max. 50 Kopien/ml ist es HIV-positiven Mitarbeitern im Gesundheitswesen erlaubt, chirurgische und invasive Tätigkeiten auszuüben, wenn sie doppelte Handschuhe tragen, regelmäßig Kontrolluntersuchungen durch Arbeitsmediziner und Fachärzte mit Erfahrung in der Behandlung von HIV vornehmen und eine vierteljährliche Kontrolle der viralen Belastung durchführen lassen.“60
Standardisierte präoperative Dekolonisation
Eine standardisierte präoperative Dekolonisation zur Vermeidung von MDRO- (Multi-Drug-Resistant Organisms) Kolonisationen in der Nase, auf der Haut und im Oropharynx vor elektiven Eingriffen kann das Infektionsrisiko senken.50,51,52
Patientenbezogene Aktivitäten
Verschiedene patientenbezogene Faktoren können in Korrelation mit postoperativen Wundinfektionen gesehen werden, z. B. Diabetes, Zigarettenkonsum, Obesitas, weitere Infektionsherde oder Kolonisation.21 Somit können auch die Patienten selbst zur Prävention beitragen – sie sollten dazu ermutigt werden, diese Risikofaktoren zu reduzieren und gleichzeitig ein Bewusstsein für ihre eigene Gesundheit zu entwickeln: das „Patient Empowerment“.
Überwachung
Die Überwachung ist ein wichtiges Instrument im Kampf gegen Infektionen wie SSI und stellt Operateuren Feedbacks mit aussagekräftigen Daten zur Verfügung, die die entsprechenden Risiken reduzieren oder minimieren.26 Die neue Richtlinie des „CDC and Healthcare Infection Control Practices Advisory Committee“ zur Prävention postoperativer Wundinfektionen wurde aufgrund der Ergebnisse eines erfolgreichen Überwachungsprogramms26 veröffentlicht und ersetzt die vorige Richtlinie „Guideline for Prevention of Surgical Site Infection“ von Mangram et al. 1999.13
Produktempfehlung zur Risikoprävention
Literaturangaben
1 WHO. (2016). Hand Hygiene and the Surgical Patient Journey. http://www.who.int/gpsc/5may/EN_PSP_GPSC1_5May_2016/en/ (accessed Aug. 2016).
2 WHO. (2011). Report on the Burden of Endemic Health Care-Associated Infection Worldwide. WHO: Geneva.
3 B. Braun. (2016). Surgical Site Infections – Risk Prevention by Surgical Gloving. https://www.bbraun.com/content/dam/catalog/bbraun/bbraunProductCatalog/CW_01_NEW/en-01/b43/surgical-site-infections.pdf.bb-.09744868/surgical-site-infections.pdf (accessed Aug. 2016).
4 CDC. (2009). Surgical Site Infection (SSI) Toolkit. http://www.cdc.gov/HAI/ssi/ssi.html (accessed Aug. 2016).
5 Centers for Disease Control and Prevention. (CDC). April 2015. http://www.cdc.gov/nhsn/PDFs/pscManual/9pscSSIcurrent.pdf (accessed Nov. 5, 2015).
6 http://www.who.int/gpsc/5may/hh_infographic_A3_EN.pdf?ua=1 (accessed May 10, 2016).
7 Tanner J et Parkinson H. Double gloving to reduce surgical cross-infection (Review). The Cochrane Library 2009, Issue 4.
8 Mischke C, Verbeek JH, Saarto A, Lavoie M-C, Pahwa M & Ijaz S. Gloves, extra gloves or special types of gloves for preventing percutaneous exposure injuries in healthcare personnel (Review). The Cochrane Database of Systematic Reviews 2014, Issue 3, Art. No.: CD009573. DOI: 10.1002/14651858.CD009573.pub2.
9 Harnoß J-C, Partecke LI, Heidecke C-D, Hübner N-O, Kramer A & Assadian O. Concentration of bacteria passing through puncture holes in surgical gloves. Am J Infect Control 2010;38:154-8.
10 Carter AH, Casper DS, Parvizi J, Austin MS. A prospective analysis of glove perforation in primary and revision total hip and total knee arthroplasty. Journal of Arthroplasty (2012) 27:7 (1271-1275).
11 De Castro-Peraza ME, Garzon-Rodriguez E, Rodriguez-Perez V, Sosa-Alvarez I, Gutierrez-Hernandez J & Asiain-Ugarte C. Glove perforation in surgery and protective effect of double gloves. Enfermeria Clinica (2010) 20:2 (73-79).
12 Junker T, Mujagic E, Hoffmann H, Rosenthal R, Misteli H, Zwahlen M, Oertli D, Tschudin-Sutter S, Widmer AF, Marti WR & Weber WP. Prevention and control of surgical site infections: review of the Basel SSI Cohort Study. Swiss medical weekly (2012) 142 (w13616).
13Mangram AJ, Horan TC, Pearson ML, Silver LC & Jarvis WR. Hospital Infection Control Practices Advisory Committee. Guideline for prevention of surgical site infection. Infect Control Hosp Epidemiol 1999;20:247-78.
14NICE, National Institute for Health and Care Excellence, UK. Surgical Site Infections: prevention and treatment. NICE guidelines [CG74]. Published date: October 2008. https://www.nice.org.uk/guidance/cg74 (Accessed Nov., 05, 2015)
15 Berrios-Torres SI. Surgical Site Infection (SSI) Toolkit. Division of Healthcare Quality Promotion, Centers for Disease Control and Prevention (CDC), Department of Health & Human Services USA, 2009. http://www.cdc.gov/HAI/pdfs/toolkits/SSI_toolkit021710SIBT_revised.pdf (Accessed Nov., 05, 2015)
16 Public Health England, Dec. 2013. Surveillance of Surgical Site Infections in NHS Hospitals in England 2012/13. https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/364319/SSI_annual_report_2012_to_13_final.pdf (Accessed: Nov., 11, 2015)
17 Public Health England, Dec. 2014. Surveillance of Surgical Site Infections in NHS Hospitals in England: 2013 to 2014. https://www.gov.uk/government/publications/surgical-site-infections-ssi-sur-veillance-nhs-hospitals-in-england (Accessed Nov., 05, 2015)
18 Tarantola A, Abiteboul D & Rachline A. Infection risks following accidental exposure to blood or body fluids in health care workers: a review of pathogens transmitted in published cases. Am J Infect Control 2006;34:367–75.
19 Deuffic-Burban S, Delarocque-Astagneau D, Abiteboul D, Bouvet E & Yazdanpanah Y. Blood-borne viruses in health care workers: Prevention and management. J. of Clinical Virology, Vol. 52, Issue 1, 4-10, Sept. 2011.
20 FitzSimons D, Francois G, De Carli G, Shouval D, Pruss-Ustun A, Puro V et al. Hepatitis B virus, hepatitis C virus and other bloodborne infections in health-care workers: guidelines for prevention and management in industrialised countries. Occup Environ Med 2008;65:446–51.
21 Wicker S, Jung J, Allwinn R, Gottschalk R & Rabenau HF. Prevalence and prevention of needlestick injuries among health care workers in a German university hospital. Int Arch Occup Environ Health 2008;81:347–54.
22 Alamgir H, Cvitkovich Y, Astrakianakis G, Yu S & Yassi A. Needlestick and other potential blood and body fluid exposures among health care workers in British Columbia, Canada. Am J Infect Control 2008;36:12–21.
23 Hofmann F, Kralj N & Beie M. Needle stick injuries in healthcare—frequency, causes and preventive strategies. Gesundheitswesen 2002;64:259–66.
24 Deisenhammer S, Radon K, Nowak D & Reichert J. Needlestick injuries during medical training. J Hosp Infect 2006;63:263–7.
25 Henderson DK, Dembry L, Fishman NO, Grady C, Lundstrom T, Palmore TN, Sepkowitz KA, Weber DJ for the Society for Healthcare Epidemiology of America. SHEA Guideline for Management of Healthcare Workers Who Are Infected with Hepatitis B Virus, Hepatitis C Virus, and/or Human Immunodeficiency Virus. Infect Control Hosp Epidemiol 2010, Vol. 31, No. 3:203-32.
26 Centers for Disease Control and Prevention (CDC), April 2015. http://www.cdc.gov/nhsn/PDFs/pscManual/9pscSSIcurrent.pdf (Accessed Nov., 05, 2015)
27 Reichman DE & Greenberg JA. Reducing surgical site infections: A Review. Rev Obstet Gynecol 2009; 2(4):212-221.
28 Rajvir Singh, Pooja Singla & Uma Chaudhary. Review Article - Surgical Site Infections: Classification, Risk factors, Pathogenesis and Preventive Management. International Journal of Pharma Research and Health Sciences Volume 2 (3), 2014, Page-203-214, e-ISSN: 2348-64652014.
29 Kabiling CS. Intraoperative glove perforation and incidence of surgical site infection. Colorectal Disease (2011) 13 SUPPL. 5 (59).
30 Beldame J, Lagrave B, Lievain L, Lefebvre B, Frebourg N & Dujardin F. Surgical glove bacterial contamination and perforation during total hip arthroplasty implantation: When gloves should be changed. Orthopaedics and Traumatology: Surgery and Research (2012) 98:4 (432-440).
31 Kuroyanagi N, Nagao T, Sakuma H, Miyachi H, Ochiai S, Kimura Y, Fukano H & Shimozato K. Risk of surgical glove perforation in oral and maxillofacial surgery. International Journal of Oral and Maxillofacial Surgery (2012) 41:8 (1014-1019).
32 Partecke LI, Goerdt A-M, Langner I, Jaeger B, Assadian O, Heidecke C-D, Kramer A, Huebner N-O. Incidence of Microperforation for Surgical Gloves Depends on Duration of Wear. Infection Control and Hospital Epidemiology, Vol. 30, No. 5 (May 2009), pp. 409-414.
33 Han CD, Kim J, Moon SH, Lee BH, Kwon HM & Park KK. A Randomized Prospective Study of Glove Perforation in Orthopaedic Surgery: Is a Thick Glove More Effective? Journal of Arthroplasty (2013) 28:10 (1878-1881).
34Demircay E, Unay K, Bilgili MG & Alataca G. Glove perforation in hip and knee arthroplasty. Journal of Orthopaedic Science (2010) 15:6 (790-794).
35 Feng T, Yohannan J, Gupta A, Hyndman ME & Allaf M. Microperforations of surgical gloves in urology: minimally invasive versus open surgeries. The Canadian Journal of Urology (2011) 18:2 (5615-5618).
36 Dhar D. Occult glove perforation during adult elective orthopaedic surgery. Macedonian Journal of Medical Sciences (2011) 4:4 (399-402).
37 Witzke HJ, Fuchs S, Schmitz E, Wittmann A, Kralj N, Vetter HO. Surgical glove perforation-Raising the bar for safety during cardiac surgery. Thoracic and Cardiovascular Surgeon (2012) 60 SUPPL. 1.
38 Shimantani M, Matsui Y, Sakakibara K, Iwase T & Yano K. Investigation of the rate of glove perforations in orthopedic procedures with an indicator underglove system (IUS) in a Japanese hospital. American Journal of Infection Control (2009) 37:5 (E117-E118).
39 Timler D, Bończak O, Jończyk J, Iltchev P, Śliwczyński A & Marczak M. Risk assessment of accidental exposure of surgeons to blood during orthopedic surgery. Are we safe in surgical gloves? Annals of Agricultural and Environmental Medicine 2014, Vol 21, No 1, 212–216.
40 Centers for Disease Control and Prevention (CDC), 2015.Healthcare-associated Infections (HAI) Progress Report. http://www.cdc.gov/hai/progress-report/index.html (Accessed Nov., 05, 2015)
41 Urban JA. Cost Analysis of Surgical Site Infections. Surgical Infections, Vol. 7, Suppl. 1, S19-S22, 2006.
42 Graf K, Ott E, Vonberg R-P, Kuehn C, Schilling T, Haverich A & Chaberny, IF. Surgical site infections – economic consequences for the health care system. Langenbecks Arch Surg (2011), 396: 453-459.
43 Perencevich EN, Sands KE, Cosgrove SE, Guadagnoli E, Meara E & Platt R. Health and economic impact of surgical site infections diagnosed after hospital discharge. Emerg Infect Dis. 2003 Feb; 9(2):196-203.
44 Centers for Disease Control and Prevention (CDC), June 2013. The National Institute for Occupational Safety and Health (NIOSH). STOP STICKS CAMPAIGN. http://www.cdc.gov/niosh/stopsticks/sharpsinjuries.html (Accessed Nov., 05, 2015)
45 Hatcher IB. Reducing Sharps Injuries Among Health Care Workers: A Sharps Container Quality Improvement Project. Jt Comm J Qual Improv 2002;28(7):410-414.
46 National Health Service for Scotland (NHS Scotland). Needlestick Injuries: Sharpen Your Awareness. Report of the Short Life Working Group on Needlestick Injuries in the NHS Scotland. Edinburgh: National Health Services for Scotland:2001.
47 Tan L, Hawk JC, Sterling ML. Report of the Council Scientific Affairs: Preventing Needlestick Injuries in Health Care Settings. Arch Intern Med 2001;161(7):929-936.
48 Jain R, Kralovic SM, Evans ME, Ambrose M, Simbartl LA, Obrosky DS, Render ML, Freyberg RW, Jernigan JA, Muder RR, Miller LJ & Roselle GA. Veterans Affairs Initiative to Prevent Methicillin-Resistant Staphylococcus aureus Infections. N Engl J Med 2011; 364:1419-30.
49 Harris AD, Pineles L, Belton B, Johnson K, Shardell M, Loeb M, Newhouse R, Dembry, L, Braun B, Perencevich EN, Hall KK, Morgan DJ and the Benefi ts of Universal Glove and Gown (BUGG) investigators. Universal Glove and Gown Use and Acquisition of Antibiotic resistant bacteria in the ICU: A Randomized Trial. JAMA. 2013 October 16; 310(15): 1571–1580. doi:10.1001/jama.2013.277815.
50 Schweizer M, Chiang H, Septimus E, Moody J, Braun B, Hafner J, et al. Association of a bundled intervention with surgical site infections among patients undergoing cardiac, hip, or knee surgery. The “STOP SSI”-Study. JAMA. 2015;313:2162-71.
51 Lepelletier D, Saliou P, Lefebvre A, Lucet J, Grandbastien B, Bruyère F, et al. Preoperative risk management: strategy for Staphylococcus aureus preoperative decolonization“ (2013 update). Med Mal Infect. 2013;44:261-7.
52 Bode L, Kluytmans J, Wertheim H, Bogaers D, Vandenbroucke-Grauls C & Roosendaal R, et al. Preventing surgical-site infections in nasal carriers of Staphylococcus aureus. N Engl J Med. 2010;362;1:9-17.
53 Wittmann A, Kralj N, Kover J, Gasthaus K & Hofmann F. Study of blood contact in simulated surgical needlestick injuries with single or double latex gloving. Infection Control and Hospital Epidemiology (2009) 30:1 (53-56).
54 Din SU & Tidley MG. Needlestick fluid transmission through surgical gloves of the same thickness. Occupational Medicine (2014) 64:1 (39-44).
55 Casanova LM, Rutala WA, Weber DJ, Sobsey MD. Effect of single- Versus double-gloving on virus transfer to health care workers‘ skin and clothing during removal of personal protective equipment. American Journal of Infection Control (2012) 40:4 (369-374).
56 Fry DE, Harris WE, Kohnke EN & Twomey CL. Influence of Double-Gloving on Manual Dexterity and Tactile Sensation of Surgeons. Journal of the American College of Surgeons (2010) 210:3 (325-330).
57 Childs T. Use of Double Gloving to Reduce Surgical Personnel‘s Risk of Exposure to Bloodborne Pathogens: An Integrative Review. AORN Journal (2013) 98:6 (585-593).
58 Guo YP, Wong PM, Li Y & Or PPL. Is double-gloving really protective? A comparison between the glove perforation rate among perioperative nurses with single and double gloves during surgery. American Journal of Surgery 2012 204:2 (210-215).
59 Birnbach DJ, Rosen LF, Fitzpatrick M, Carling P, Arheart KL & Munoz-Price LS. Double gloves: A randomized trial to evaluate a simple strategy to reduce contamination in the operating room. Anesthesia and Analgesia (2014).
60 Rabenau HF, Gottschalk R, Gürtler L, Haberl AE, Hamouda O, Himmelreich H, Korn K, Mertens T, Schmidt KW, Schmiedel S, Spickhoff A, Wirz G, Wutzler P & Wicker S. Prävention der nosokomialen Übertragung von humanem Immunschwächevirus (HIV) durch HIV-positive Mitarbeiterinnen und Mitarbeiter im Gesundheitswesen Empfehlungen der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) e.V. und der Gesellschaft für Virologie (GfV) e.V. Bundesgesundheitsbl 2012 · 55:937–943 - DOI 10.1007/s00103-012-1546-8.