Sie haben sich erfolgreich abgemeldet.
Noch nicht registriert?
Partikelkontamination in Pädiatrie und Neonatologie
Was ist Partikelkontamination?
Partikelkontaminationen stellen in der Pädiatrie und Neonatologie ein großes Risiko da. Der Begriff bezeichnet das unbeabsichtigte Vorhandensein von fremden, beweglichen und ungelösten Partikeln in parenteralen Lösungen.1,2
Ursachen für Partikelkontaminationen sind vor allem Arzneimittel, die in unterschiedlichen Behältnissen bereitgestellt werden – z. B. in Durchstechflaschen, Ampullen, Fertigspritzen oder vorgefertigten Mischlösungen.
Zahlreiche Arten von Partikelkontamination entstehen durch Glas-, Kunststoff- oder Gummipartikel sowie ungelöste Feststoffe. Diese Partikel können in ihrer Größe stark variieren und bei neonatologischen und pädiatrischen Patient*innen ernsthafte Schäden verursachen.

Wussten Sie, dass auf einer Intensivstation schätzungsweise bis zu 1 Million Partikel pro Tag infundiert werden?3, 4
Warum stellt Partikelkontamination ein Risiko in der Pädiatrie dar?
Partikel in Infusionslösungen gelten generell als zusätzlicher Risikofaktor für Intensivpatient*innen.5 Sie erhöhen das Risiko für Thrombosen, gestörte Mikrozirkulation und eine veränderte Immunantwort.6 In der Pädiatrie ist die Gefahr durch Partikelkontamination besonders ausgeprägt.
Mehrere Studien dokumentieren die potenziellen Folgen für kritisch kranke Kinder. Die Infusion von Partikeln kann:
- zur Bildung pulmonaler Granulome führen⁷
- Veränderungen der Mikrozirkulation auslösen und damit eine systemische Entzündungsreaktion mit schädlichen Auswirkungen auf Organe verursachen6
- schwere Komplikationen8 oder sogar den Tod9, 10 zur Folge haben.
Neugeborene auf der Intensivstation sind aufgrund ihres physiologischen Zustands und der Tatsache, dass ihnen häufig mehrere injizierbare Arzneimittel gleichzeitig verabreicht werden, besonders gefährdet. Sehr geringe Flüssigkeitsmengen können zu einer unvollständigen Auflösung des Arzneimittels führen und das Risiko von Arzneimittelinkompatibilitäten erhöhen.11
Bei Neugeborenen kann die Infusion von Partikeln Komplikationen wie Entzündungen, Sepsis und Enterokolitis verstärken.12
Im Vergleich zu Erwachsenen hat die Injektion von Partikeln bei pädiatrischen und neonatologischen Patient*innen weitaus gravierendere Auswirkungen. Ein möglicher Grund hierfür sind unterschiedliche kardiovaskuläre Eigenschaften: Neugeborene verfügen über eine geringere Anzahl und kleinere Durchmesser von Blutgefäßen in den pulmonalen Kapillaren.13, 14
Umso wichtiger ist es, Partikelkontamination in Pädiatrie und Neonatologie zu vermeiden.
Wie lässt sich das Risiko einer Partikelkontamination verringern?
Die folgenden Maßnahmen können helfen, das Risiko einer Partikelkontamination in der Pädiatrie zu verringern:
- Verwenden Sie hochwertige Materialien, z. B. Durchstechstopfen, die keine Partikel freisetzen.
- Vermeiden Sie Glasampullen. Nutzen Sie stattdessen Kunststoffbehälter mit geringer intrinsischer Partikelbelastung.
- Vermeiden Sie Arzneimittel-Inkompatibilitäten, um Ausfällungen und Reaktionen zu verhindern.
- Setzen Sie in der Pädiatrie und Neonatologie intravenöse Inline-Filter ein.
Aufgrund der Bedeutsamkeit des Einsatzes von Partikelfiltern, insbesondere in der Neonatologie, gehen wir darauf noch einmal im Detail ein.
Die British Pharmaceutical Nutrition Group (BPNG) empfiehlt den Einsatz geeigneter Filter bei der Verabreichung von parenteraler Ernährung an immungeschwächte Patient*innen – etwa Kinder und Neugeborene – um eine Kontamination mit unlöslichen Partikeln zu vermeiden.15
Inline-Filter werden empfohlen, um die Partikelbelastung bei Infusionen über zentrale Venenkatheter zu reduzieren und die Zufuhr von Bakterien und Endotoxinen zu verhindern.16
Die Inline-Filtration kann das Auftreten schwerwiegender Komplikationen infolge von Partikelkontaminationen bei kritisch kranken pädiatrischen und neonatologischen Patient*innen signifikant senken. Dazu zählen:
- SIRS (Systemisches inflammatorisches Response-Syndrom),
- Sepsis,
- Kreislaufversagen,
- ARDS (Akutes Atemnotsyndrom),
- Thrombosen,
- akutes Nieren- oder Leberversagen.
Die Gesamtkomplikationsrate dieser schwerwiegenden Ereignisse konnte durch den Einsatz von IV-Filtern um 10 % reduziert werden: von 40,9 % auf 30,9 %.17
Der Einsatz von Partikelfiltern in der Neonatologie ist damit ein wichtiger Baustein in der Risikoprävention.
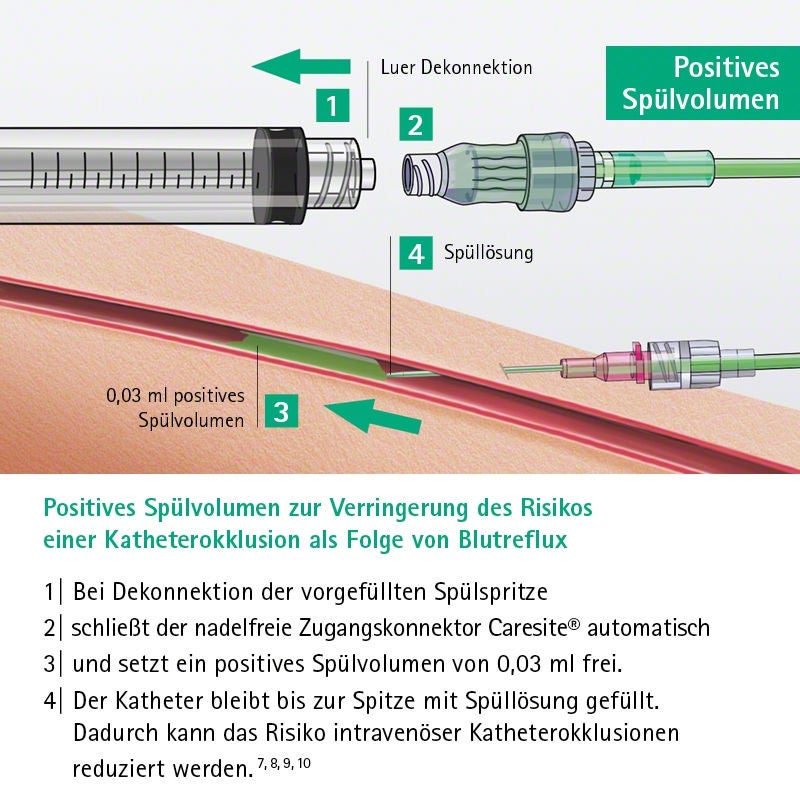
Wie IV-Inline-Filter Risiken in der Medikation reduzieren
- Rückhalt von Partikeln
- Elimination von Endotoxinen*
- Rückhalt von Luftblasen
- Filtration von Bakterien
* Gilt für Intrapur® Filter in unserem Portfolio
Standardisierte Prozesse können helfen, schwere Komplikationen auf Intensivstationen zu vermeiden und die Patientensicherheit zu erhöhen.
Binden Sie den Einsatz geeigneter Inline-Filter fest in Ihre täglichen Abläufe auf pädiatrischen und neonatologischen Intensivstationen ein, um das Risiko einer Partikelkontamination wirksam zu minimieren.
Neben einer reduzierten Morbidität profitieren pädiatrische Patient*innen bei reduzierter Partikelkontamination von kürzeren Liegezeiten und einer geringeren Dauer der maschinellen Beatmung.¹⁷
Das bedeutet: Frühere Entlassung aus der Intensivstation, schneller zurück ins Leben, zu den Familien, ins „einfach Kindsein“.
Sicherheitsprodukte hervorheben
Risikoprävention in Pädiatrie und Neonatologie
Haben Sie Fragen zur Partikelkontamination in der Pädiatrie und Neonatologie?
Kontaktieren Sie unsQuellennachweise
1. Mehrkens HH, Klaus E, Schmitz JE. Possibilities of material contamination due to additional injections. Klin Anasthesiol Intensivther. 1977;14:106-13.
2. Walpot H, Franke RP, Burchard WG, Agternkamp C, Müller FG, Mittermayer C, Kalff G. Particulate contamination of infusion solutions and drug additives within the scope of long-term intensive therapy. 1. Energy dispersion electron images in the scanning electron microscope-REM/EDC. Anasthesist. 1989;38(10):544-8.
3. Werner BP, Winter G. (2015) Particle contamination of parenteralia and in-line filtration of proteinaceous drugs. Int J Pharm;496(2):250-67
4. Doessegger L, Mahler HC, Szczesny P, Rockstroh H, Kallmeyer G, Langenkamp A, Herrmann J, Famulare J. (2012) The potential clinical relevance of visible particles in parenteral drugs. J Pharm Sci; 101(8): 2635-44
5. Jack T. Micro Particles Contamination. Innocent Bystander or Real Threat? 2012 (Presentation: „_Micro Particles Contamination_Jack_MHH_2012“).
6. Boehne M, Jack T, Köditz H, Seidemann K, Schmidt F, Abura M, Bertram H, Sasse M. In-line filtration minimizes organ dysfunction: new aspects from a prospective, randomized, controlled trial. BMC Pediatr. 2013;13:21.
7. Puntis JW, Wilkins KM, Ball PA, Rushton DI, Booth IW. Hazards of parenteral treatment: do particles count? Arch Dis Child 1992 Dec;67(12):1475–7.
8. Breaux CW, Duke D, Georgeson KE, Mestre JR. Calcium phosphate crystal occlusion of central venous catheters used for total parenteral nutrition in infants and children: prevention and treatment. J Pediatr Surg 1987 Sep;22(9):829–32.
9. Bradley JS, Wassel RT, Lee L, Nambiar S. Intravenous ceftriaxone and calcium in the neonate: assessing the risk for cardiopulmonary adverse events. Pediatrics 2009 Apr;123(4):e609–13.
10. Monte SV, Prescott WA, Johnson KK, Kuhman L, Paladino JA. Safety of ceftriaxone sodium at extremes of age. Expert Opin Drug Saf 2008 Sep;7(5):515–23.
11. Perez M, Maiguy-Foinard A, Barthélémy C, Décaudin B, Odou P. Particulate Matter in Injectable Drugs: Evaluation of Risks to Patients. Pharmaceutical Technology in Hospital Pharmacy 2016;1(2):91-103.
12. Van Lingen RA, Baerts W, Marquering ACM, Rujis GJHM. The use of in-line filtration in sick newborn infants. Acta paediatrica 2004; 93:1-5.
13. Heyman S. Toxicity and safety factors associated with lung perfusion studies with radiolabeled particles. J Nucl Med Off Publ Soc Nucl Med 1979 Oct;20(10):1098–9.
14. Lofthus RM, Srebnik HH. The physical dimensions of the human neonatal cardiovascular system. J Biomech Eng 1987 Nov;109(4):336–9.
15. Bethune K Allwood M, Grainger C, Wormleighton C; British Pharmaceutical Nutrition Group Working Party. (2001) Use of filters during the preparation and administration of parenteral nutrition: position paper and guidelines prepared by a British pharmaceutical nutrition group working party. Nutrition;17(5):403-8.
16. Virlouvet AL, Pansiot J, Toumazi A et al. In-line filtration in very preterm neonates: a randomized controlled trial. Sci Rep 2020; 10(5003).
17. Jack T, Boehne M, Brent BE, Hoy L, Köditz H, Wessel A, Sasse M. In-line filtration reduces severe complications and length of stay on pediatric intensive care unit: a prospective, randomized, controlled trial. Intensive Care Med. 2012; 38:1008–1016.